某高温还原法制备新型陶瓷氮化铝(AlN)的反应体系中的物质有:Al2O3.C.N2.AlN.CO
(1)请将AlN之外的反应物与生成物分别填入以下空格内,配平,并标出电子转移的方向和数目
(2)若反应中共转移3.01 ×1023个电子,则该反应产生气体的体积为: (标准状况下)
(3)氮化铝也能由氯化铝与氨气经气相反应制得:AlCl3+NH3  AlN+3HCl反应中,该方法比前者在生产上更具优势。下列说法中,正确的是 。
AlN+3HCl反应中,该方法比前者在生产上更具优势。下列说法中,正确的是 。
A.前一方法中的 Al2O3.C.N2结构稳定,反应时破坏化学键需要消耗更多的能量
B.前一方法中的Al2O3和C容易残留在氮化铝中
C.两种方法中氮化铝均为还原产物
下图是化学实验中常用的几种装置。
请回答下列问题: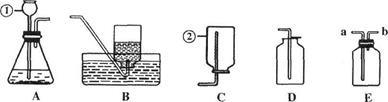
(1)指出有编号的仪器名称:① ,② 。
(2)利用上述A、D装置的组合可以制取的一种气体是 ,写出实验室制取该气体的化学反应方程式 。
(3)若用E装置收集该气体,则气体应从 (选“a”或“b”)导入;若用E装置干燥生成的气体,E中盛放的液体试剂是 。
(4)在实验室如使用碳酸钠与稀盐酸、选用A装置制二氧化碳,需要对A装置进行的改进是 。
如图所示:A、B、C、D是初中化学中常见的不同类别的物质,已知A、B是空气中的两种气体,“ ”表示两种物质在一定条件下可相互转变。依据给出的信息推断并回答下列问题:
”表示两种物质在一定条件下可相互转变。依据给出的信息推断并回答下列问题: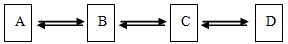
(1)B转化为A的过程叫 ;
(2)B物质的一种用途是 ;
(3)C物质所属的类别是 ;
(4)D转化为C的反应方程式是 。
如图是稀盐酸和氢氧化钠溶液反应过程中溶液酸碱度的变化情况。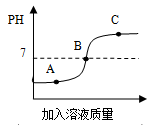
(1)该实验操作是将 滴加到另一种溶液中。
(2)A点时溶液中的溶质是 (填化学式)。
(3)右下图是反应中某时的微观图示,此时对应于上图中A、B、C中的哪一点? ;证明你的判断正确的实验操作方法是:向反应后的溶液中滴加 溶液。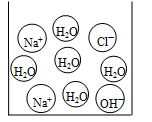
如下左图是甲、乙两种物质的溶解度曲线,右图所示两个烧杯中各盛有20℃时两种物质的饱和溶液。请你通过分析,回答下列问题:

(1)下列方法中能使甲物质的溶解度增大的是
| A.溶解时搅拌 | B.升高温度 | C.降低温度 | D.增加水的质量 |
(2)在80℃时,将55克甲物质放到50克水中,形成溶液的质量是 克。
(3)不改变溶质质量分数使接近饱和的乙的不饱和溶液变为饱和溶液的方法是 。
(4)当温度由20℃升高到60℃时(不考虑水分蒸发),B烧杯中固体质量增多,则B烧杯溶液中的溶质是 (填“甲”或“乙”)。
(5)将80℃的甲、乙饱和溶液降温到40℃,得到的溶液中溶质的质量分数大小关系是甲 乙(填“>”、“=”或“<”)。
(6)甲中含有少量乙时,提纯甲的方法是 。
电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。某工程师为了从使用过的腐蚀废液中回收铜,并重新获得FeCl3溶液,准备采用下列步骤: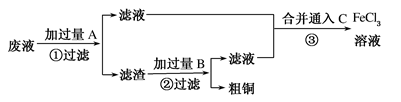
(1)写出FeCl3溶液与Cu反应的离子方程式___________,若Fe和Cu及稀硫酸构成原电池,_______可做负极材料。可通过向滤液中加入________(填化学式)溶液来检验Fe3+的存在,现象是__________。
(2)写出上图步骤③相关反应的化学方程式:③____________。C还可以用______(填化学式),用这种物质反应后不引入新的杂质。
(3)请写出焊接钢轨时发生反应的化学方程式 。