下列叙述错误的是
| A.硝酸银溶液通常保存在棕色试剂瓶中,因为硝酸银见光易分解 |
| B.乙醇的沸点比甲醚(CH3—O—CH3)高,主要原因是乙醇分子间作用力更大 |
| C.反应AgCl + Br- → AgBr + Cl-能在水溶液中进行,是因为AgBr比AgCl更难溶于水 |
| D.常温下浓硫酸可贮存在铁制或铝制容器中,说明常温下铁和铝与浓硫酸不反应 |
在一密闭容器中,反应aA(气) bB(气)达到平衡后,保持温度不变,将容器体积增大一倍,当达到新平衡时,B的浓度是原来的40%,则
bB(气)达到平衡后,保持温度不变,将容器体积增大一倍,当达到新平衡时,B的浓度是原来的40%,则
| A.平衡向正反应方向移动了 | B.物质A的转化率减小了 |
| C.物质B的质量分数增加了 | D.a< b |
在相同条件下(T=500k),相同体积甲、乙两容器,甲充入1gSO2、1gO2,乙充入2gSO2、2gO2.下列叙述错误的是
| A.化学反应速率乙>甲 | B.平衡后O2浓度乙>甲 |
| C.SO2转化率乙>甲 | D.平衡后SO2的体积分数乙>甲 |
关于中和热测定实验的下列说法不正确的是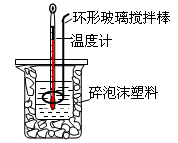
| A.烧杯间填满碎泡沫塑料是减少实验过程中的热量损失 |
| B.使用环形玻璃棒既可以搅拌又避免损坏温度计 |
| C.向盛装酸的烧杯中加碱时要小心缓慢 |
| D.测了酸后的温度计要用水清洗后再测碱的温度 |
在一定温度下将1mol CO和3mol水蒸气放在密闭的容器中发生下列反应:CO(g)+H2O(g)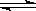 CO2(g)+H2(g)达到平衡后,测得CO2为0.75mol,再通入6mol水蒸气,达到新的平衡后,CO2和H2的物质的量之和为
CO2(g)+H2(g)达到平衡后,测得CO2为0.75mol,再通入6mol水蒸气,达到新的平衡后,CO2和H2的物质的量之和为
| A.1.2mol | B.1.5mol | C.1.8mol | D.2.5mol |
某温度下,相同pH值的盐酸和醋酸溶液分别加水稀释,平衡pH值随溶液体积变化的曲线如图所示。据图判断正确的是
| A.Ⅱ为盐酸稀释时的pH值变化曲线 |
| B.b点溶液的导电性比c点溶液的导电性强 |
| C.a点KW的数值比c点KW的数值大 |
| D.b点酸的总浓度大于a点酸的总浓度 |