25℃,加水稀释10mLpH=11的氨水,下列判断正确的是
| A.原氨水的浓度=10-3mol /L |
| B.氨水的电离程度增大,溶液中所有离子的浓度均减小 |
C.溶液中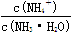 的增大 的增大 |
| D.再加入10mLpH=3的盐酸,混合液pH=7 |
碳酸的酸性比硅酸强,某化学课外小组搜集了大量的证据证明硅酸的酸性弱于碳酸酸性。其中能证明硅酸的酸性弱于碳酸酸性的实验事实是( )
| A.CO2溶于水形成碳酸,SiO2难溶于水 |
| B.CO2通入可溶性硅酸盐中析出硅酸沉淀 |
| C.高温下SiO2与碳酸钙、碳酸钠等固体反应生成CO2 |
| D.氯化氢通入可溶性碳酸盐溶液中放出气体,通入可溶性硅酸盐溶液中生成沉淀 |
下列表述正确的是()
①人造刚玉熔点很高,可用作高级耐火材料,主要成分是二氧化硅
②化学家采用玛瑙研钵摩擦固体反应物进行无溶剂合成,玛瑙的主要成分是硅酸盐
③提前建成的三峡大坝使用了大量水泥,水泥是硅酸盐材料
④夏天到了,游客佩戴由添加氧化亚铜的二氧化硅玻璃制作的变色眼镜来保护眼睛
⑤太阳能电池可采用硅材料制作,其应用有利于环保、节能
| A.①②③ | B.②④ | C.③④⑤ | D.③⑤ |
下列物质间的转化不能通过一步反应完成的是()
| A.SiO2→Si | B.CO2→C | C.SiO2→H2SiO3 | D.Si→Na2SiO3 |