在100 mL某浓度的NaOH溶液中通入一定量的CO2气体,得到溶液X,再向溶液X中逐滴加入0.1mol/L的盐酸,产生的气体体积与加入盐酸的体积关系如下图所示,有关说法错误的是( )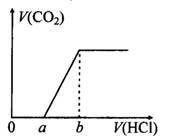
| A.若a:b<1:2,则0~a段发生的离子反应为:CO32-+H+= HCO3- |
| B.若a:b>l:2,且b="20" mL,则原NaOH溶液的浓度为0.02 mol/L |
| C.若a:b=1:2,则溶液X中离子浓度满足:c(H+)+c(HCO3-)=c(OH-)-c(H2CO3) |
| D.a:b为任意值时,溶液X中离子浓度均满足:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-) |
如图,对A生成C的反应,下列所得结论正确的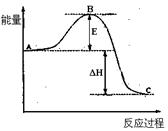
| A.该反应进行时,一定有能量放出 |
| B.该反应为吸热反应 |
| C.A物质比C物质稳定 |
| D.该反应肯定很容易,不需要加热就可以进行 |
下列属于氧化还原反应,且为吸热反应的是
| A.CaO+H2O====Ca(OH)2 | B.2Al+Fe2O3 2Fe+Al2O3 2Fe+Al2O3 |
C.C+H2O  CO+H2 CO+H2 |
D.2NaOH+H2SO4===Na2SO4+2H2O |
已知在1×105Pa,298 K条件下,4 g 氢气燃烧生成液态水放出572 kJ热量,下列表示氢气燃烧的热化学方程式的是
| A.H2O(g) = H2(g)+1/2 O2(g)△H=+286kJ·mol-1 |
| B.2H2(g)+ O2(g)=2H2O(l)△H=-572kJ·mol-1 |
| C.H2(g)+ 1/2O2(g)= H2O(g)△H=-286kJ·mol-1 |
| D.H2(g)+1/2 O2(g)=H2O(l)△H=+286 kJ·mol-1 |
下列有关元素周期表(律)说法正确的是
| A.最外层有两个电子的原子一定在IIA 族 |
| B.IA族均为碱金属 |
| C.同一周期核电荷数越大原子半径越大 |
| D.同一主族金属元素核电荷数越大元素金属性越强 |
下列递变规律正确的是
| A.热稳定性:HCl>HF>H2O | B.元素的最高正化合价:F>S>C>K |
| C.碱性:NaOH>Mg(OH)2>Ca(OH)2 | D.沸点:金刚石>硫>水>氮气 |