据报道,以硼氢化合物NaBH4(B元素的化合价为+3价) 和H2O2作原料的燃料电池,负极材料采用Pt/C, 正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如下图所示,下列说法正确的是( ) 
| A.电池放电时,Na+从b极区移向a极区 |
| B.电极a采用MnO2,放电时它被还原 |
| C.该电池负极的电极反应式为:BH4-+8OH––8e– = BO2-+6H2O |
| D.放电时,a极区溶液的pH升高,b极区溶液pH降低 |
下列物质用途不正确的是
| A.用二氧化硫漂白纸张 | B.用氯气制备漂白粉 |
| C.用食盐作调味剂 | D.用烧碱治疗胃酸过多 |
下列说法不正确的是
| A.维生素都易溶于水 | B.CO2和CH4都是温室气体 |
| C.加碘食盐不能使淀粉液变蓝 | D.灼烧法可区别纯棉和纯毛织物 |
下列化学用语正确的是
A.CO2的电子式: |
B.Cl原子的结构示意图: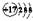 |
C.CH4分子的比例模型: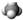 |
D.质量数为23的钠原子:11 23Na |
下列叙述正确的是
| A.K与N连接时,X为硫酸,一段时间后溶液的pH减小 |
| B.K与N连接时,X为氯化钠,石墨电极反应:2H++2e- = H2↑ |
| C.K与M连接时,X为氯化钠,石墨电极反应:4OH- -4e- =2H2O+O2↑ |
| D.K与M连接时,X为硫酸,一段时间后溶液的pH减小 |
某同学研究铝及其化合物的性质时设计了如下两个实验方案。
方案①:2.7 g Al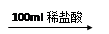 X溶液
X溶液 Al(OH)3沉淀
Al(OH)3沉淀
方案②:2.7 g Al Y溶液
Y溶液 Al(OH)3沉淀
Al(OH)3沉淀
NaOH溶液和稀盐酸的浓度均是3 mol/L,如图是向X溶液和Y溶液中分别加入NaOH溶液和稀盐酸时产生沉淀的物质的量与加入盐酸和氢氧化钠溶液体积之间的关系,下列说法正确的是
| A.X溶液溶质为AlCl3,Y溶液溶质为NaAlO2 |
| B.b曲线表示的是向X溶液中加入NaOH溶液 |
| C.在O点时两方案中所得溶液浓度相等 |
| D.a、b曲线表示的反应都是氧化还原反应 |