7000C时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g)  CO2(g)+H2(g);反应过程中测定的部分数据见下表(表中t2>t1)
CO2(g)+H2(g);反应过程中测定的部分数据见下表(表中t2>t1)
| 反应时间/min |
n(CO)/mol |
n(H2O)/mol |
| 0 |
1.20 |
0.60 |
| t1 |
0.80 |
|
| t2 |
|
0.20 |
下列说法中正确的是
A.反应在t1 min内的平均速率为υ(CO2)=  mol·L-1·min-1
mol·L-1·min-1
B.到t1 min时,反应未达平衡状态
C. 保持7000C不变,向平衡体系中再通入0.60molCO和0.30 molH2O,达到新平衡时与原平衡相比,CO转化率增大,H2的体积分数增大
D.温度升至8000C时,上述反应的平衡常数为0.64,则正反应为放热反应
以下对粒子结构或性质的叙述正确的是()
| A.两种微粒,若核外电子排布完全相同,则化学性质一定相同 |
| B.由单原子形成的离子,一定具有稀有气体元素原子核外电子排布 |
| C.阴离子的核外电子排布一定与上一周期稀有气体原子核外排布相同 |
| D.两原子,如果核外电子排布相同,则一定属于同一种元素 |
对某酸性溶液(可能含有Br―,SO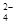 ,H2SO3,NH
,H2SO3,NH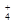 )分别进行如下实验:
)分别进行如下实验:
①加热时放出的气体可以使品红溶液褪色
②加碱调至碱性后,加热时放出的气体可以使润湿的红色石蕊试纸变蓝;
③加入氯水时,溶液略显黄色,再加入BaCl2溶液时,产生的白色沉淀不溶于稀硝酸
对于下列物质不能确认其在溶液中是否存在的是 ()
| A.Br― | B.SO42- | C.H2SO3 | D.NH4+ |
某元素X核电荷数小于18,其原子的电子层数为n,最外层电子数为2n+1,原子核内质子数是2n2-1。下列有关X的说法中,不正确的是()
| A.X能形成化学式为X(OH)3的碱 |
| B.X能形成化学式为NaXO3的含氧酸钠盐 |
| C.X原子的最外层电子数和核电荷数不可能为偶数 |
| D.X能与某些金属元素或非金属元素形成化合物 |
FeS与一定浓度的HNO3反应,生成Fe(NO3)3、Fe2(SO4)3、NO2、N2O4、NO和H2O,当NO2、N2O4、NO的物质的量之比为1︰1︰1时,实际参加反应的FeS与HNO3的物质的量之比为()
| A.1∶6 | B.1∶7 | C.2∶11 | D.16∶25 |
下列叙述正确的是()
| A.常温时,某溶液中由水电离出来的c(H+)和c(OH-)的乘积为1×10-24,该溶液中一定可以大量存在K+、Na+、AlO2-、SO42- |
| B.常温时,0.1mol/L HA溶液的pH>1,0.1mol/L BOH溶液中c(OH-)/c(H+)=1012,将这两种溶液等体积混合,混合后溶液中离子浓度的大小关系为:c(B+)>c(OH-)>c(H+)>c(A-) |
| C.过量SO2通入到Ba(NO3)2溶液中,正确的离子反应方程式为:3SO2+2NO3-+3Ba2++2H2O=3BaSO4↓+2NO↑+4H+ |
| D.常温下,稀释0.1 mol/L的氨水,溶液中c(OH-)、c(NH4+)、c(H+)均下降 |