下列关于电解质溶液说法正确的是 ( )
| A.水的离子积常数Kw随着温度的升高而增大,说明水的电离是放热反应 |
| B.等体积的pH都为3的酸HA和HB分别与足量的Mg反应,HA放出的H2多,说明酸性:HA>HB |
| C.常温下,弱酸酸式盐NaHA溶液的pH=6,说明HA‾的电离程度大于其水解程度 |
| D.pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,水的电离程度相同 |
短周期元素X,Y,Z、W在周期表中的位置如右图所示,则下列说法中错误的是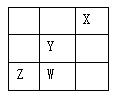
A.X,Y,Z中X的单质最稳定 |
B.W的最高价氧化物对应的水化物的化学式为HWO4 |
C.Y能溶于水生成HYO和HY |
| D.能发生Cl2 + H2Z="===Z" + 2HCl的反应 |
对可逆反应:2A(g) + B(s)  3C(s) + 2D(g);ΔH﹤0 下图所示为正逆反应速率(v)与时间(t)关系的示意图,
3C(s) + 2D(g);ΔH﹤0 下图所示为正逆反应速率(v)与时间(t)关系的示意图, 如果在t1时刻改变以下条件:①升温; ②加入催化剂;
如果在t1时刻改变以下条件:①升温; ②加入催化剂; ③加入A;④加压;⑤减少C,
③加入A;④加压;⑤减少C,
符合图示的条件是()

| A.②④ | B.①② |
| C.③④ | D.④⑤ |
根据反应(1)Br2 +2Fe2+=2Br-+2Fe3+ ; (2)2Fe3+ + 2I-= 2Fe2+ + 2I2,可判断离子的还原性由强到弱的顺序正确的是()
| A. Br- > Fe2+ >I- | B.Fe2+>I-> Br-_ |
| C.Br->I-> Fe2+ | D.I-> Fe2+ > Br- |
将足量Na2O2 投入FeCl2 溶液中, 可观察到的现象是( )
①生成白色沉淀 ②生成红褐色沉淀 ③有气泡产生 ④反应后溶液变无色。
| A.①④ | B.②③④ |
| C.①③ | D.① |
下列关于可逆反应:2SO2 + O2 2SO3的说法正确的是()
2SO3的说法正确的是()
| A.1mol SO2与足量O2反应,可以生成1mol SO3 |
| B.平衡时,c(SO2)∶c(O2)∶c(SO3)=2∶1∶2 |
| C.当O2的质量不再变化时,反应达到平衡 |
| D.当反应达到平衡状态时,v(O2)=0 |