(1) 常温下,已知0.1 mol·L-1一元酸HA溶液中c(OH-) / c(H+)=1×10-8。
①常温下,0.1 mol·L-1 HA溶液的pH= ;写出该酸(HA)与NaOH溶液反应的离子方程式: ;
②pH=3的HA与pH=11的NaOH溶液等体积混合后,溶液中4种离子物质的量浓度大小关系是: 。
(2) 常温下,向pH=a的氨水中加入等体积盐酸时,溶液呈中性,则此盐酸的pH 14-a(>、<、=)
(3) 向物质的量浓度均为0.01mol·L-1的MnCl2和BaCl2混合溶液中,滴加Na2CO3溶液,先沉淀的离子是 ,当两种难溶电解质共存时,溶液中c(Ba2+)/c(Mn2+) 。(此温度下,Ksp(BaCO3)=8.1×10-9、Ksp(MnCO3)=1.8×10-11)
(4)设Ka、Kh、Kw分别表示CH3COOH的电离平衡常数、CH3COO-的水解平衡常数和水的离子积常数,则三者之间的关系为:
某链烃A 1 mol,在一定条件下完全分解(裂解)成1 mol烷烃B和1 mol烯烃C,生成的混合气体对氢气的相对密度为14.5。通过计算回答下列问题:
(1)写出链烃A可能的结构简式和名称。
(2)烷烃B和烯烃C可能各是什么?
(3)如果要求1 mol B完全燃烧时需要的氧气的物质的量是整数,那么C只能是什么烯烃?
标准状况下1.68 L无色可燃气体在足量氧气中完全燃烧。若将产物通入足量澄清石灰水中,得到的白色沉淀质量为15.0 g;若用足量碱石灰吸收燃烧产物,增重9.3 g。
(1)计算燃烧产物中水的质量。
(2)若原气体是单一气体,通过计算推断它的分子式。
(7分)燃烧法是测定有机化合物化学式的一种重要方法。现在完全燃烧0.1 mol某烃,燃烧产物依次通过右图所示的装置,实验结束后,称得甲装置增重10.8 g,乙装置增重11.2 g。求该烃的分子式,并写出其所有同分异构体的结构简式。
将等物质的量的A、B混合于2 L的密闭容器中,发生反应:3A(g)+B(g) xC(g)+2D(g),经5 min后,测得D的浓度为0.5 mol/L,c(A)∶c(B)=3∶5,C的平均反应速率是0.1 mol/(L·min)。求:
xC(g)+2D(g),经5 min后,测得D的浓度为0.5 mol/L,c(A)∶c(B)=3∶5,C的平均反应速率是0.1 mol/(L·min)。求:
(1)反应开始前放入容器中的A、B的物质的量;
(2)x的值;
(3)B的平均反应速率。
将等物质的量的A、B、C、D四种物质混合放入V L密闭容器中,发生如下反应:aA+bB cC(s)+dD,当反应进行到第t min时,测得A减少了n mol,B减少了
cC(s)+dD,当反应进行到第t min时,测得A减少了n mol,B减少了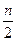 mol,C增加了
mol,C增加了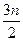 mol,D增加了n mol。此时反应达到平衡。
mol,D增加了n mol。此时反应达到平衡。
(1)该化学方程式中,各物质的化学计量数分别为:a=__________、b=__________、c=__________、d=__________。
(2)以B的浓度变化表示的该化学反应的速率为v(B)=______________________________。
(3)若只改变压强,反应速率发生变化,但平衡不发生移动,该反应中各物质的聚集状态是:A__________、B__________、D__________。
(4)若只升高温度,反应一段时间后,测知四种物质的物质的量又达到相等,则该反应为__________反应。(填“放热”或“吸热”)