已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中元素A、E的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素C、D原子的最外层上均有一个未成对电子。下列说法正确的是
A.C、D分别与E形成的化合物的晶体类型相同
B.B与E形成的分子BE4为非极性分子
C.一定条件下,元素C、D的最高价氧化物对应的水化物之间能发生反应
D.化合物AE与CE含有相同类型的化学键
下列化合物中,核磁共振氢谱只出现两组峰且峰面积之比为3:2的是
下列说法或表示方法中正确的是
| A.吸热反应中,新化学键形成吸收能量;放热反应中,新化学键形成放出能量 |
| B.等质量的硫蒸气和硫磺分别完全燃烧,后者放出的热量多 |
| C.相同体积浓度均为0.1 mol/L 盐酸和醋酸溶液分别与足量的NaOH稀溶液反应,前者放出热量多 |
| D.氢气的燃烧热为285.8 kJ/mol,则氢气燃烧的热化学方程式为:2H2(g)+O2(g)===2H2O(l) ΔH=-285.8 kJ/mol |
下列说法正确的是
| A.某有机物燃烧只生成CO2和H2O,且二者物质的量相等,则此有机物组成为CnH2n |
| B.一种烃在足量的氧气中燃烧并通过碱石灰,减少的体积就是生成水蒸气的体积 |
| C.相同质量的烃,完全燃烧,消耗O2越多,烃中含C%越高 |
| D.某气态烃CxHy与足量O2恰好完全反应,如果反应前后气体体积不变(温度150℃),则y=4,若体积增加,则y>4,否则y<4 |
向ZnSO4溶液中加入Na2S溶液时,得到白色沉淀,然后向白色沉淀中滴加CuSO4溶液,发现沉淀变为黑色,则下列说法不正确的是
| A.白色沉淀为ZnS,黑色沉淀为CuS |
| B.上述现象说明ZnS的Ksp小于CuS的Ksp |
| C.利用该原理可实现一种沉淀转化为更难溶的沉淀 |
| D.该过程破坏了ZnS的溶解平衡 |
已知分子式为C12H12的物质A的结构简式为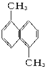 ,其苯环上的二溴代物有9种同分异构体,由此推断A苯环上的四溴代物的同分异构体的数目有
,其苯环上的二溴代物有9种同分异构体,由此推断A苯环上的四溴代物的同分异构体的数目有
| A.9种 | B.10种 | C.11种 | D.12种 |