常温下,将某一元碱BOH和HCl溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
| 实验编号 |
HCl的物质的量浓度 (mol·L-1) |
BOH的物质的量浓度 (mol·L-1) |
混合溶液的pH |
| ① |
0.1 |
0.1 |
pH=5 |
| ② |
c |
0.2 |
pH=7 |
| ③ |
0.1 |
0.2 |
pH>7 |
请回答:
(1)从第①组情况分析,BOH是 (选填“强碱”或“弱碱”)。该组所得混合溶液中由水电离出的
c(OH—)= mol·L-1。
(2)第②组情况表明,c 0.2。该混合液中离子浓度c(B+) c(Cl—)(选填“<”、“>”或“=”)。
(3)从第③组实验结果分析,混合溶液中 (选填“<”、“>”或“=”)
甲:BOH的电离程度 BCl的水解程度
乙:c(B+)—2 c (OH—) c(BOH)—2 c(H+)
现有下列4种物质:① NH3、② NO2、③Cl2、④NaHCO3溶液。其中,常温下为黄绿色气体是(填序号,下同),能使湿润的红色石蕊试纸变蓝的气体是,红棕色的气体是,与盐酸反应能生成气体的溶液是。
铝热反应在工业上有广泛应用:2Al+ Fe2O3 2Fe + Al2O3 。在该反应中,作为氧化剂的物质是(填化学式),作为还原剂的物质是(填化学式);若反应中生成了 2mol Fe,则需消耗mol Al。
2Fe + Al2O3 。在该反应中,作为氧化剂的物质是(填化学式),作为还原剂的物质是(填化学式);若反应中生成了 2mol Fe,则需消耗mol Al。
已知A、B、C、D、E均为中学化学中常见物质,在一定条件下相互转化关系如下图所示(反应条件和部分产物已省略)。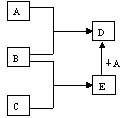
请回答:(1)若A为金属单质,B、C为非金属单质,且常温下B、C均为无色气体,D为黑色固体,则B的化学式为,A与E在一定条件下反应生成D的化学方程式为
。
(2)若A为非金属单质,且常温下为黄绿色气体,B为金属单质,C为酸,且C的组成中含有与A相同的元素。则构成非金属单质A的元素原子结构示意图为, A与E在一定条件下反应生成D的离子方程式为。
有A、B、C、D、E五种透明溶液,它们分别是盐酸、AgNO3、BaCl2、NaCl、Na2CO3,按下面顺序两两混合,其现象如下表:
若A为Na2CO3,则B~E分别是:B;C;D;E。
(1)向AlCl3溶液中,滴加少量NaOH溶液,现象是,
继续滴加NaOH溶液至过量,现象是。
(2)钠与水反应的离子方程式为,该反应中氧化剂是,产生1mol H2时,转移电子的物质的量为mol。