我国有丰富的天然气资源。以天然气为原料合成尿素的主要步骤如下图所示(图中某些转化步骤及生成物未列出):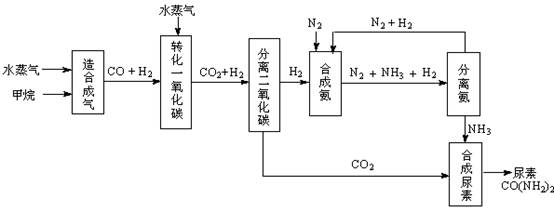
(1)“造合成气”发生的热化学方程式是CH4(g)+H2O(g)  CO(g)+3H2(g);△H>0
CO(g)+3H2(g);△H>0
在恒温恒容的条件下,欲提高CH4的反应速率和转化率,下列措施可行的是 。
A、增大压强 B、升高温度 C、充入He气 D、增大水蒸气浓度
(2)“转化一氧化碳”发生的方程式是H2O(g) +CO(g)  H2(g)+CO2(g),该反应平衡常数随温度的变化如下:
H2(g)+CO2(g),该反应平衡常数随温度的变化如下:
| 温度/℃ |
400 |
500 |
800 |
| 平衡常数K |
9.94 |
9 |
1 |
提高氢碳比[ n(H2O)/n(CO)],K值 (填“增大”、“不变”或“减小”);若该反应在400℃时进行,起始通入等物质的量的H2O和CO,反应进行到某一时刻时CO和CO2的浓度比为1∶3,此时v(正) v(逆)(填“>”、“=”或“<”)。
(3)有关合成氨工业的说法中正确的是 。
A、该反应属于人工固氮
B、合成氨工业中使用催化剂能提高反应物的利用率
C、合成氨反应温度控制在500℃左右,目的是使化学平衡向正反应方向移动
D、合成氨工业采用循环操作的主要原因是为了加快反应速率
(4)生产尿素过程中,理论上n(NH3)∶n(CO2)的最佳配比为 ,而实际生产过程中,往往使n(NH3)∶n(CO2)≥3,这是因为 。
(5)当甲烷合成氨气的转化率为60%时,以3.0×108 L甲烷为原料能够合成 L 氨气。(假设体积均在标准状况下测定)
11分)铁及其化合物在日常生活、生产中应用广泛.研究铁及其化合物的应用意义重大.
I.水体的净化和污水的处理与铁及其化合物密切相关.
(1)自来水厂常用高铁酸钠(Na2FeO4)改善水质.简述高铁酸钠用于杀菌消毒同时又起到净水作用的原理 .
(2)碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂,在医药上也可用于治疗消化性溃疡出血.工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下: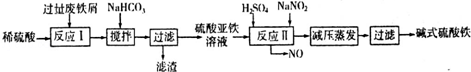
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Al(OH)3 |
| 开始沉淀 |
2.3 |
7.5 |
3.4 |
| 完全沉淀 |
3.2 |
9.7 |
4.4 |
回答下列问题:
①写出反应I中主要发生的氧化还原反应的离子方程式 .
②加入少量NaHCO3的目的是调节溶液pH,应控制pH的范围为 .
③在实际生产中,反应II常同时通入O2以减少NaNO2的用量,若通入5.6L O2(标准状况),则相当于节约NaNO2的质量为 g.
④碱式硫酸铁溶于水后产生的[Fe(OH)]2+离子,可部分水解生成[Fe2(OH)4]2+聚合离子.该水解反应的离子方程式为 .
II铁的化合物也是制备高能锂电池的重要原料.已知磷酸亚铁锂电池总反应为:FePO4+Li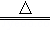 LiFePO4,电池中的固体电解质可传导Li+.试写出该电池充电时的阳极反应式 .
LiFePO4,电池中的固体电解质可传导Li+.试写出该电池充电时的阳极反应式 .
(1)环境专家认为可以用铝将水中的NO3﹣ 转化为N2,从而清除污染.该反应中涉及的粒子有:H2O、Al、OH﹣、Al(OH)3、NO3﹣、N2,请将各粒子分别填入以下空格(请将整个方程式配平后写在答题纸上).
NO3﹣+ + → + + ﹣ 该反应过程中,被氧化与被还原的元素的物质的量之比为 .
(2)若4Al(s)+3O2(g)=2Al2O3(s)△H=﹣a KJ/mol
Fe2O3(s)+C(s)=CO2(g)+2Fe (s)△H="+b" KJ/mol
C(s)+O2(g)=CO2(g)△H=﹣c KJ/mol
写出Al与氧化铁发生铝热反应的热化学方程式: .
(3)将一定质量的钠铝合金置于水中,合金全部溶解,得到20mL PH=14的溶液,然后用2mol/L的盐酸滴定,可得到沉淀量与消耗的盐酸体积关系如图:则反应过程中产生氢气的总体积为 L(标准状况)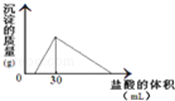
有A、B、C、D四种含硅元素的物质,它们能发生如下反应:
①C与烧碱反应生成A和水;②A溶液与钙盐溶液反应生成白色沉淀D;
③B在空气中燃烧生成C;④C在高温下与碳反应生成单质B.
根据上述变化,完成下列问题:
(1)写出B、D的化学式:B 、D .
(2)写出C与烧碱反应的化学方程式: .写出A溶液与钙盐溶液反应的离子方程式: .
氰(CN)2、硫氰(SCN)2的化学性质和卤素很相似,化学上称为“类卤素”,它们阴离子的还原性强弱为:Cl﹣<Br﹣<CN﹣<SCN﹣<I﹣.
试写出:
(1)(CN)2与KOH(aq)反应的化学方程式: ;
(2)NaBr和KSCN的混合溶液中加入足量(CN)2反应的离子方程式: .
X、Y、Z、Q、R是五种短周期元素,原子序数依次增大。X、Y两元素最高正价与最低负价之和均为0;Q与X同主族;Z、R分别是地壳中含量最高的非金属元素和金属元素。请回答下列问题:
(1)五种元素原子半径由大到小的顺序是(写元素符号) 。
(2)由以上某些元素组成的化合物A、B、C、D有如下转化关系:A B(在水溶液中进行)。其中,C是溶于水显酸性的气体,D是淡黄色固体。写出C的结构式: ;D的电子式: 。
B(在水溶液中进行)。其中,C是溶于水显酸性的气体,D是淡黄色固体。写出C的结构式: ;D的电子式: 。
①如果A、B均由三种元素组成,B为两性不溶物,则A的化学式为 ;由A转化为B的离子方程式为 。
②如果A由三种元素组成,B由四种元素组成,A、B溶液均显碱性。用离子方程式表示A溶液显碱性的原因: 。(用离子方程式表示)