铜单质及其化合物在很多领域有重要的用途,如超细铜粉可应用于导电材料、催化剂等领域中。超细铜粉的某制备方法如下:
(1)[Cu(NH3)4]SO4中,N、O、S三种元素的第一电离能从大到小的顺序为: 。
(2) SO42-中硫原子的杂化轨道类型是 :写出一种与SO42-互为等电子体的分子 。
(3)某反应在超细铜粉做催化剂作用下生成 ,则分子中 σ 键与 π 键之比为
,则分子中 σ 键与 π 键之比为
(4)该化合物[Cu(NH3)4]SO4中存在的化学键类型有 。(填字母)
| A.离子键 | B.金属键 | C.配位键 | D.非极性键 E.极性键 |
(5)NH4CuSO3中的金属阳离子的核外电子排布式为 。
(6)铜的某氯化物的晶胞结构如右图所示,该化合物的化学式为 。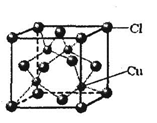
下列叙述正确的是
| A.可用分液漏斗分离溴和四氯化碳 |
| B.CH3COOCH3核磁共振氢谱中只给出一种信号 |
| C.乙醇(CH3CH2OH)和二甲醚(CH3—O—CH3)互为碳链异构体 |
| D.与氢气加成得到2,3-二甲基戊烷的烯烃结构式有5种 |
下列关于晶体的说法正确的是
| A.熔化二氧化硅和金刚石时所克服的粒子间的作用力类型同种 |
| B.原子晶体的熔点一定比金属的高 |
| C.构成分子晶体的微粒一定含有共价键 |
| D.晶体中只要有阳离子就一定有阴离子 |
氨分子空间构型是三角锥形,键角小于109°28′,而甲烷是正四面体,键角等于109°28′,键角差别是因为
| A.两种分子的中心原子杂化轨道类型不同,NH3为sp2杂化,而CH4是sp3杂化 |
| B.NH3分子中N原子形成三个杂化轨道,CH4分子中C原子形成4个杂化轨道 |
| C.NH3分子中有一对未成键的孤电子对,它对成键电子对的排斥作用较强 |
| D.氨气分子是极性分子而甲烷是非极性分子 |
已知X、Y元素同周期,且电负性X>Y,下列说法错误的是
| A.X与Y形成化合物时X显负价,Y显正价 |
| B.第一电离能X大于Y |
| C.最高价氧化物对应的水化物的酸性:X强于Y |
| D.气态氢化物的稳定性:HmX强于HmY |
下列叙述中,正确的是
| A.在一个基态多电子的原子中,可以有两个运动状态完全相同的电子 |
| B.在一个基态多电子的原子中,不可能有两个能量完全相同的电子 |
| C.在一个基态多电子的原子中,M层上的电子能量肯定比N层上的电子能量低 |
| D.在一个基态多电子的原子中,如果某一能级上有多个未成对电子,它们自旋方向必然相同 |