信息时代产生的大量电子垃圾对环境构成了极大的威胁。某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到红色金属M和金属E并进行如下框图所示转化,获得高效净水剂K2EO4。
(答题时,化学式及化学方程式中的M、E均用所对应的元素符号表示):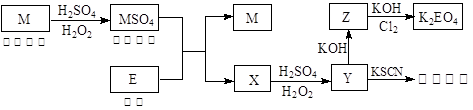
(1)写出M溶于稀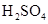 和
和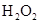 混合液的离子方程式: 。
混合液的离子方程式: 。
(2)检验X中阳离子的方法和现象是 。
(3)某同学取X的溶液在空气中放置后,酸化并加入KI和淀粉溶液,溶液变为蓝色。写出与上述变化过程相关的离子方程式: 、 。
(4)由MSO4的蓝色溶液经一系列操作可以获得蓝色晶体,这些操作中用到的实验仪器除了酒精灯、蒸发皿、铁架台外,还需要用到的玻璃仪器有 、 、 (填写仪器名称)。
(5)某同学利用H2还原MO来测定M的相对原子质量,下图是测定装置示意图,A中试剂是盐酸。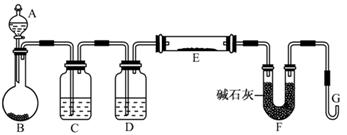
①仪器B中应装入 ,装置D的作用 ;
②连接好装置并检验装置的气密性后,应首先“加热反应管E”还是“从A瓶中逐滴加入液体” ?
在这两步之间还应进行的操作是 ;
(2014届安徽省“江南十校”高三3月联考理综化学试卷)
草酸亚铁晶体(FeC2O4·2H2O)用作分析试剂及显影剂和新型电池材料磷酸亚铁锂的生产。回答下列问题:
I.兴趣小组对草酸亚铁晶体的分解产物进行实验和探究。探究分解得到的固体产物中铁元素的存在形式。
(1)提出假设
假设一:___________;假设二:全部是FeO ;假设三:FeO和Fe混合物。
(2)设计实验方案证明假设三。
| 实验步骤 |
现象与结论 |
| 步骤1:向试管中加入少量固体产物,再加入足量 ,充分震荡 |
若溶液颜色明显改编,且有 生成,则证明有铁单质存在 |
| 步骤2:将步骤1中得到的浊液过滤,并用蒸馏水洗涤至洗涤液无色 |
|
| 步骤3:去步骤2得到少量固体与试管中,滴加 |
|
限选试剂:稀盐酸、新制的氯水、0.1mol.L-1CuSO4溶液、20% KSCN溶液、蒸馏水。
Ⅱ.兴趣小组在文献中查阅到,FeC2O4·2H2O受热分解时,固体质量随温度变化的曲线如下图所示,写出加热到400℃时,FeC2O4·2H2O晶体受热分解的化学方程式为:_______________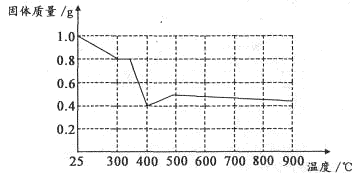
根据图象,如有1.0g草酸亚铁晶体在坩埚中敞口充分加热,最终残留黑色固体的质量大于0.4g。某同学由此得出结论:假设二不成立。你是否同意该同学的结论,并简述理由:______________________。
(2014届安徽省安庆市高三第二次模拟理综化学试卷)
为检验一批因露置而部分变质的Ba(OH) 2药品的成分,某化学探究性学习小组设计了方案对其进行分析:将20.45g药品分成五等分,逐渐加入100mL1 mol/L的盐酸中,并充分搅拌,测得生成气体的体积(已换算为标准状况下)、剩余固体的量与固体加入量的关系如图所示。考虑到某地附近为硫酸工业区,该小组同学判断此药品可能含三或四种成分。
(1) 写出硫酸工业尾气与过量的Ba(OH) 2反应的离子方程式:
(2)提出以下三种合理假设:(已知在空气中Ba(OH) 2很难生成酸式盐)
假设一:药品成分为Ba(OH) 2和BaSO4、BaSO3;假设二:药品成分为Ba(OH) 2和________________;
假设三:药品成分为Ba(OH) 2和________________。
(3)实验验证:为确定该药品的成分,该小组利用上述实验中生成的气体,选择适当的试剂进行探究,请设计合理方案填入下表:
| 实验操作 |
预期实验现象和结论 |
| 若____________________,假设一成立; 若____________________,假设二成立; 若____________________,假设三成立。 |
(4)问题讨论:若经试验验证,此药品为四种成分混合物,该小组同学认为由上述曲线可知,当所加固体质量为12.27 g时,药品成分与盐酸刚好完全反应,你认为该组同学的判断是否正确______。(填“是”或者“否”)
(2014届安徽省安庆市六校高三第三次联考理综化学试卷)
硫代硫酸钠(Na2S2O3)可看成是一个S原子取代了Na2SO4中的一个O原子而形成。某校化学研究性学习小组运用类比学习的思想,通过实验探究Na2S2O3的化学性质。请填写以下空白:
【提出问题】Na2S2O3是否与Na2SO4相似具备下列性质呢?
猜想①:________________________。猜想②:溶液呈中性,且不与酸反应。
猜想③:无还原性,不能被氧化剂氧化。
【实验探究】基于上述猜想②、③,设计实验方案。请填写下列表格中的(1)(2)(3)。
| 实验操作 |
实验现象 或预期实验现象 |
现象解释 (用离子方程式表示) |
|
| 猜想② |
|
溶液pH约8—10 |
|
| 向pH=2的硫酸中滴加Na2S2O3溶液 |
|
S2O32—+2H+=S↓+SO2↑+H2O |
|
| 猜想③ |
向新制氯水(pH<2)中滴加少量Na2S2O3溶液 |
氯水颜色变浅 |
|
【实验结论】Na2S2O3能与酸反应,具有还原性,与Na2SO4的化学性质不相似。
【问题讨论】
(1)甲同学向探究“猜想③”反应后的溶液中滴加硝酸银溶液,观察到有白色沉淀产生,并据此认为氯水可将Na2S2O3氧化。你认为该方案是否正确并说明理由___________________________________。
(2)请重新设计一个实验方案,证明Na2S2O3被氯水氧化。该实验方案是 。
(2014届安徽省蚌埠市三县联谊校高三第二次联考理综化学试卷)
某研究性学习小组的同学为验证浓硫酸与铜能反应而稀硫酸不能,设计了如图所示装置进行探究:将6.4 g铜片和含0.2 moL溶质的18.4 mol/L浓硫酸放在圆底烧瓶中共热,直到无气体生成为止。(假定在此过程溶液体积不变)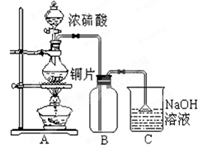
(1)甲同学认为要证实上述结论,还应进行稀硫酸与铜片混合加热实验,你认为有无必要,并说明理由:________________
(2)下列试剂中能够用来进一步证明反应结束后的烧瓶中确有余酸的是:_____
| A.铁粉 | B.钠 | C.氯化钡溶液 | D.银粉 |
(3)为定量测定余酸的物质的量浓度,甲、乙两位同学进行了如下设计:
Ⅰ甲同学设想:在A装置增加一个导管通氮气驱赶气体(假定生成的气体全部逸出),先测定生成的SO2的量,然后计算剩余硫酸的浓度。他设计了如下二种方案来测定SO2的量:
方案① 将产生的气体缓缓通入足量用稀硫酸酸化的KMnO4溶液,再加入足量BaCl2溶液,过滤、洗涤、干燥、称量沉淀。
方案② 将气体缓缓通入足量硝酸钡溶液中,然后过滤、洗涤、干燥、称量沉淀。
经仔细分析后,发现有不合理之处,请填写下表(可以不填满):
| 序号 |
不合理的原因 |
误差 (偏低或偏高) |
改变措施 |
| 方案① |
|||
| 方案② |
Ⅱ乙学生设计的方案是:分离出反应后的溶液并加蒸馏水稀释至1000 mL,取20.00 mL于锥形瓶中,滴入2~3滴酚酞指示剂,用标准NaOH溶液进行滴定(已知氢氧化铜开始沉淀的pH约为5),这种方法能否求出余酸的浓度,理由是_______________________________________。
(4)请再设计其他可行的实验方案,来测定余酸的物质的量浓度,简要写出操作步骤及需要测定的数据(不必计算,不必写操作细节)_____________________________________________________。
(2014届北京市西城区高三4月一模考试理综化学试卷)
某小组对Cu与浓HNO3的反应进行研究。记录如下: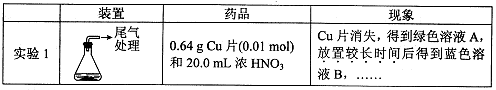
I.Cu与浓HN03反应的化学方程式是 。
II.探究实验1中溶液A呈绿色而不是蓝色的原因。
(1)甲认为溶液呈绿色是由Cu2+离子浓度较大引起的。乙根据实验记录,认为此观点不正确,乙的依据是 。
(2)乙认为溶液呈绿色是由溶解的NO2引起的。进行实验2:先将NO2通入B中,再鼓入N2。结果证实假设成立。则以上两步操作对应的现象分别是 、 。
(3)为深入研究,丙查阅资料,有如下信息:
i.溶有NO2的、浓HNO3呈黄色;水或稀HNO3中通少量NO2溶液呈无色。
ii.NO2溶于水,会发生反应2NO2+H2O =HNO3+HNO2HNO2是弱酸,只能稳定存在于冷、稀的溶液中,否则易分解。
iii.NO—2能与Cu2+反应:Cu2+(蓝色)+4 NO2-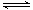 Cu(NO2)42-(绿色)
Cu(NO2)42-(绿色)
据此,丙进一步假设:
①可能是A中剩余的浓HNO3溶解了NO2得到的黄色溶液与Cu(NO3)2的蓝色溶液混合而形成的绿色;
②可能是A中生成了Cu(NO2)2—4使溶液呈绿色。
丙进行如下实验:
①亚硝酸分解的化学方程式是 。
②请用平衡原理解释加入稀H2SO4后绿色溶液变蓝的原因: 。
(4)根据实验得出结论:实验l中溶液A呈绿色的主要原因是 ,请依据实验现象阐述理由: 。