在100ml含等物质的量的HBr和H2SO3的溶液中通入0.025molCl2,有一半Br-变为Br2。则原溶液中HBr和H2SO3的浓度都等于( )
| A.0.16mol/L | B.0.02mol/L | C.0.20mol/L | D.0.25mol•L‾1 |
用标准盐酸滴定未知浓度的氢氧化钠溶液,下列操作情况会使测得的氢氧化钠溶液浓度偏低的是
| A.酸式滴定管用水润洗后,直接注入标准浓度的盐酸 |
| B.滴定过程中,滴定管有少量漏液 |
| C.滴定前读数准确,滴定完毕俯视读数 |
| D.锥形瓶用水润洗后,再用待测的氢氧化钠润洗 |
有两个极易导热的密闭容器a和b(如图所示),a容器体积恒定,b容器压强恒定。在同温同压和等体积条件下,向a和b两容器中通入等物质的量的NO2,发生反应: 2NO2 N2O4△H<0,则以下说法正确的是:( )
N2O4△H<0,则以下说法正确的是:( )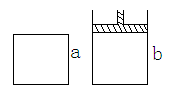
| A.反应起始时两容器的反应速率va和vb的关系:va<vb |
| B.反应过程中两容器内的反应速率va和vb的关系:va<vb |
| C.反应达到平衡时,两容器内压强相同 |
| D.反应达到平衡时,两容器的NO2的转化率相同 |
如下图所示的装置,C、D、E、F、X、Y都是惰性电极。将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色。则以下说法正确的是
A.电源B极是正极
B.(甲)、(乙)装置的C、D、E、F电极均有单质生成,其物质的量之比为1 : 2 : 2 : 2
C.欲用(丙)装置给铜镀银,H应该是Ag,电镀液是AgNO3溶液
D.装置(丁)中Y极附近红褐色变深,说明氢氧化铁胶粒带负电荷
在测定中和热的实验中,下列说法正确的是
| A.用0.5 mol·L-1NaOH溶液分别与0.5 mol·L-1的盐酸、醋酸溶液反应,如所取的溶液体积相等,则测得的中和热数值相同 |
| B.为了准确测定反应混合溶液的温度,实验中温度计水银球应与小烧杯底部接触 |
| C.使用环形玻璃搅拌棒是为了使反应物混合均匀,加快反应速率,减小实验误差 |
| D.在测定中和热实验中需要使用的仪器有:天平、量筒、烧杯、滴定管、温度计 |
已知某可逆反应:mA(g)+nB(g)  pC(g) △H在密闭容器器中进行,如图所示,反应在不同时间t、温度T和压强P与反应混合物在混合气体中的百分含量(B%)的关系曲线,由曲线分析下列判断正确的是
pC(g) △H在密闭容器器中进行,如图所示,反应在不同时间t、温度T和压强P与反应混合物在混合气体中的百分含量(B%)的关系曲线,由曲线分析下列判断正确的是
| A.T1<T2,p1>p2,m+n>p,△H>0 |
| B.T1>T2,p1<p2,m+n>p,△H>0 |
| C.T1>T2,p1<p2,m+n<p,△H<0 |
| D.T1>T2,p1>p2,m+n>p,△H<0 |