某学生欲配制6.0 mol/L的H2SO4 1 000 mL,实验室有三种不同浓度的硫酸:
①480 mL 0.5 mol/L 的硫酸;②150 mL 25%的硫酸(ρ=1.18 g/mL);③足量的18 mol/L的硫酸。有三种规格的容量瓶:250 mL、500 mL、1 000 mL。老师要求把①②两种硫酸全部用完,不足的部分由③来补充。
请回答下列问题:
(1)实验所用25%的硫酸的物质的量浓度为______mol/L(保留1位小数)。
(2)配制该硫酸溶液应选用容量瓶的规格为______mL。
(3)配制时,该同学的操作顺序如下,请将操作步骤B、D补充完整。
A.将①②两溶液全部在烧杯中混合均匀;
B.用量筒准确量取所需的18 mol/L的浓硫酸____mL,沿玻璃棒倒入上述混合液中。并用玻璃棒搅拌,使其混合均匀;
C.将混合均匀的硫酸沿玻璃棒注入所选的容量瓶中;
D._________________________________________________________________
_________________________________________________________________
E.振荡,继续向容量瓶中加水,直到液面接近刻度线1~2 cm处;
F.改用胶头滴管加水,使溶液的凹液面恰好与刻度线相切;
G.将容量瓶盖紧,振荡,摇匀。
(4)如果省略操作D,对所配溶液浓度有何影响?________(填“偏大”、“偏小”或“无影响”)。
(5)进行操作C前还需注意
。
乙醇是重要的有机化工原料,可由乙烯直接水合法或间接水合法生产。回答下列问题:
(1)间接水合法是指先将乙烯与浓硫酸反应生成硫酸氢乙酯(
)。再水解生成乙醇。写出相应的反应的化学方程式
(2)已知:
甲醇脱水反应①
△H1=-23.9KJ·mol-1
甲醇制烯烃反应②
△H2=-29.1KJ·mol-1
乙醇异构化反应③
△H3=+50.7KJ·mol-1
则乙烯气相直接水合反应
的△H= KJ·mol-1
与间接水合法相比,气相直接水合法的优点是:。
(3)下图为气相直接水合法中乙烯的平衡转化率与温度、压强的关系(其中
=1︰1)
①列式计算乙烯水合制乙醇反应在图中A点的平衡常数K=(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
②图中压强P1、P2、P3、P4的大小顺序为:,理由是:
③气相直接水合法党采用的工艺条件为:磷酸/硅藻土为催化剂,反应温度290 ℃,压强6.9MPa, =0.6︰1。乙烯的转化率为5℅。若要进一步提高乙烯的转化率,除了可以适当改变反应温度和压强外,还可以采取的措施有:、。
乙酸异戊酯是组成蜜蜂信息素质的成分之一,具有香蕉的香味,实验室制备乙酸异戊酯的反应装置示意图和有关数据如下:
实验步骤:
在
中加入4.4
的异戊醇,6.0
的乙酸、数滴浓硫酸和2~3片碎瓷片,开始缓慢加热
,回流50分钟,反应液冷至室温后,倒入分液漏斗中,分别用少量水,饱和碳酸氢钠溶液和水洗涤,分出的产物加入少量无水硫酸镁固体,静置片刻,过滤除去硫酸镁固体,,进行蒸馏纯化,收集140~143 ℃馏分,得乙酸异戊酯3.9
。回答下列问题:
(1)装置
的名称是:
(2)在洗涤操作中,第一次水洗的主要目的是:; 第二次水洗的主要目的是:。
(3)在洗涤、分液操作中,应充分振荡,然后静置,待分层后(填标号),
A.直接将乙酸异戊酯从分液漏斗上口倒出
B.直接将乙酸异戊酯从分液漏斗下口放出
C.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
D.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口放出
(4)本实验中加入过量乙酸的目的是:
(5)实验中加入少量无水硫酸镁的目的是:
(6)在蒸馏操作中,仪器选择及安装都正确的是:(填标号)
a. b.
b.
c. d.
d.
(7)本实验的产率是:
A.30℅B.40℅C.50℅D.60℅
(8)在进行蒸馏操作时,若从130 ℃开始收集馏分,产率偏(填高或者低)原因是
某小组以
、
、
、浓氨水为原料,在活性炭催化下,合成了橙黄色晶体
。为测定其组成,进行如下实验。
①氨的测定:精确称取
,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入足量10%
溶液,通入水蒸气,将样品液中的氨全部蒸出,用
的盐酸标准溶液吸收。蒸氨结束后取下接收瓶,用
标准溶液滴定过剩的
,到终点时消耗
溶液。
②氯的测定:准确称取样品
,配成溶液后用
标准溶液滴定,
溶液为指示剂,至出现淡红色沉淀不再消失为终点(
为砖红色)。
回答下列问题:
(1)装置中安全管的作用原理是。
(2)用
标准溶液滴定过剩的
时,应使用式滴定管,可使用的指示剂为。
(3)样品中氨的质量分数表达式为。
(4)测定氨前应该对装置进行气密性检验,若气密性不好测定结果将(填"偏高"或"偏低")。
(5)测定氯的过程中,使用棕色滴定管的原因是;滴定终点时,若溶液中
=2.0×10-5
,
为
。(已知:
=1.12×10-12)
(6)经测定,样品
中钴.氨.氯的物质的量之比为1:6:3,钴的化合价为,制备
的化学方程式为;
的制备过程中温度不能过高的原因是。
是重要的化工原料,易溶于水。在中性或碱性环境中稳定。
I.制备
•5
反应原理:
+

实验步骤:
①称取15
加入圆底烧瓶中,再加入80
蒸馏水。另取5
研细的硫粉,用3
乙醇润湿,加入上述溶液中。
②安装实验装置(如图所示,部分加持装置略去),水浴加热,微沸60分钟。
③趁热过滤,将滤液水浴加热浓缩,冷却析出
•5
,经过滤,洗涤,干燥,得到产品。
回答问题:
(1)硫粉在反应前用乙醇润湿的目的是。
(2)仪器
的名称是,其作用是。
(3)产品中除了有未反应的
外,最可能存在的无机杂质是,检验是否存在该杂质的方法是。
(4)该实验一般控制在碱性环境下进行,否则产品发黄,用离子方程式表示其原因:。
II.测定产品纯度
准确称取
产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.1000
碘的标准溶液滴定。
反应原理为:2
+
=
+2
(5)滴定至终点时,溶液颜色的变化:。
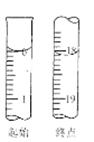
(6)滴定起始和终点的液面位置如图,则消耗碘的标准溶液体积为mL。产品的纯度为(设
•5
相对分子质量为
)。
III.
的应用
(7)
还原性较强,在溶液中易被
氧化成
,常用作脱氧剂,该反应的离子方程式为。
硫代硫酸钠是一种重要的化工产品。某兴趣小组拟制备硫代硫酸钠晶体(
)。
I.[查阅资料]
(1)
是无色透明晶体,易溶于水。其稀溶液与
溶液混合无沉淀生成。
(2)向
和
混合液中通入
可制得
,所得产品中常含有少量
,
。
(3)
易被氧化;
难溶于水,可溶于稀
。
Ⅱ.[制备产品]
实验装置如图所示(省略夹持装置)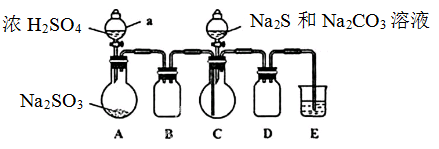
实验步骤:
(1)检查装置气密性,按图示加入试剂。仪器a的名称是;
中的试剂是(选填下列字母编号)。
A.稀
B.
溶液 C.饱和
溶液
(2)先向
中烧瓶加入
和
混合溶液,再向
中烧瓶滴加浓
。
(3)待
和
完全消耗后,结束反应。过滤
中混合液,滤液经(填写操作名称)、结晶、过滤、洗涤、干燥、得到产品。
Ⅲ.[探究与反思]
(1)为验证产品中含有
和
,该小组设计了以下实验方案,请将方案补充完整。(所需试剂从稀
、稀
、稀
、蒸馏水中选择)
取适量产品配成稀溶液,滴加足量
溶液,有白色沉淀生成,,若沉淀未完全溶解,并有刺激性气味的气体产生,则可确定产品中含
和
。
(2)为减少装置
中生成的
的量,在不改变原有装置的基础上对原有实验步骤
(2)进行了改进,改进后的操作是。
(3)
的溶解度随温度升高显著增大,所得产品通过方法提纯。