某化学式为AB的离子晶体,已知5r(A2+)=4r(B2-)(各类离子晶体与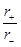 关系如下图所示),经测定其密度为
关系如下图所示),经测定其密度为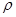 g·cm-3,其摩尔质量为Mg·mol-1,则下列有关该晶体的说法正确的是( )
g·cm-3,其摩尔质量为Mg·mol-1,则下列有关该晶体的说法正确的是( )
| r+/r- |
配位数 |
实例 |
| 0.225~0.414 |
4 |
ZnS |
| 0.414~0.732 |
6 |
NaCl |
| 0.732~1.0 |
8 |
CsCl |
| >1.0 |
12 |
CsF |
A.该晶体结构与ZnS晶体相似
B.该晶体每个晶胞中有2个A2+和B2-
C.该晶体晶胞的边长为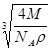 cm
cm
D.A2+离子紧邻的B2-构成的空间结构为立方体
下列除杂质的方法中正确的是()
| A.乙醇中混有乙酸,加入NaOH溶液后,用分液漏斗分液 |
| B.乙烷中混有乙烯,通入H2,在一定条件下反应使乙烯完全转化成乙烷 |
| C.苯甲醛中混有苯甲酸,加入生石灰后,再加热蒸馏 |
| D.溴苯中含有单质溴加入KI溶液后用分液漏斗分液 |
在允许加热的条件下,只用一种试剂就可以鉴别硫酸铵、氯化钾、氯化镁、硫酸铝和硫酸铁溶液,这种试剂是()
| A.NaOH | B.NH3·H2O | C.AgNO3 | D.BaCl2 |
氯化钠是一种重要的生活、生产必需品。下列表述中正确的是()
A.NaCl的电子式为 |
| B.NaCl的水溶液是强电解质 |
| C.23Na37Cl中质子数和中子数之比是8:7 |
| D.电解熔融氯化钠可得到氯气和金属钠 |
关于下列各实验装置的叙述中,正确的是()
| A.装置①制备乙酸乙酯 |
| B.装置②中X若为CCl4,可用于吸收NH3或HCl,并防止倒吸 |
| C.装置③可用于干燥、收集Cl2,并吸收多余的Cl2 |
| D.装置④配制一定物质的量浓度的溶液时转移液体 |
同温同压下某瓶充满O2时重116g,充满CO2时重122g,充满某气体时重132g,则该未知气体的相对分子质量为()
| A.28 | B.64 | C.32 | D.44 |