某充电电池的原理如图所示,溶液中c(H+)="2.0" mol·L-1,阴离子为SO42-,a、b均为惰性电极,充电时右槽溶液颜色由绿色变为紫色。下列对此电池叙述正确的是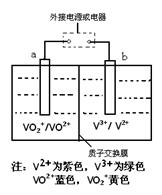
| A.放电过程中,左槽溶液颜色由黄色变为蓝色 |
| B.充电时,b极接直流电源正极,a极接直流电源负极 |
| C.充电过程中,a极的反应式为:VO2++2H++e—= VO2+ +H2O |
| D.放电时,当转移1.0 mol电子时共有1.0 mol H+从左槽迁移进右槽 |
要使有机物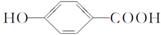 转化为
转化为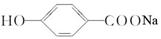 可选用的试剂是()
可选用的试剂是()
| A.Na | B.NaHCO3溶液 | C.NaCl溶 液 液 |
D.NaOH溶液 |
从中草药陈蒿中可提取一种利胆的有效成分,其结构简式为 ,推测该药物不可能具有的化学性质是()
,推测该药物不可能具有的化学性质是()
A.与FeCl3溶 液发生显色反应 液发生显色反应 |
B.与氢氧化钠溶液反应 |
| C.与浓溴水反应 | D.在稀硫酸溶液中发生水解反应 |
下列各物质不能与水发生反应的是()
| A.乙苯 | B.乙烯 | C.氯乙烷 | D.乙酸乙酯 |
1mol的有机物A,水解后生成2mol的C2H6O 和1mol的C2H2O4,该有机物可以是()
| A.CH3OOCCH2COOC2H5 | B.C2H5OOCCOOC2H5 |
C.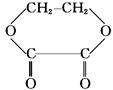 |
D.CH3COOCH2CH2OOCCH3 |
下列有机物一定是丁烯的同系物的是()
| A.C2H2 | B.C2H4 | C.C3H6 | D.C6H6 |