一定条件下,分别向容积固定的密闭容器中充入A和足量B,发生反应如下:2A(g)+B(s) 2D(g)△H<0,测得相关数据如下,分析可知下列说法不正确的是
2D(g)△H<0,测得相关数据如下,分析可知下列说法不正确的是
| |
实验Ⅰ |
实验Ⅱ |
实验Ⅲ |
| 反应温度/℃ |
800 |
800 |
850 |
| c(A)起始/mol·L-1 |
1 |
2 |
1 |
| c(A)平衡/mol·L-1 |
.0.5 |
1 |
0.85 |
| 放出的热量/kJ |
a |
b |
c |
A.实验III的化学平衡常数K<1
B.实验放出的热量关系为b>2a
C.实验III在30min达到平衡时的速率v(A)为0.005mol• L-1·min-1
D.当容器内气体密度不随时间而变化时上述反应达到平衡
在温度、容积相同的3个密闭容器中,按不同方式投人反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下表
[已知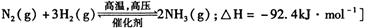

下列说法错误的是
| A.2c1 <c3 | B.a+6 ="92." 4 |
| C.2p2<p3 | D.a1 +a3<1 |
下列说法正确的是
A._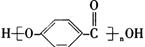 的结构中含有酯基 的结构中含有酯基 |
| B.1 - 丁烯和2-甲基-1-丙烯的加氢产物相同 |
| C.180g葡萄糖可水解生成2mol乳酸(C3H6O3) |
| D.油脂和蛋白质都是能发生水解反应的高分子化合物 |
下列各组离子在指定溶液中,一定能大量共存的是
A.常温下, 的溶液: 的溶液: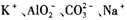 |
B.无色中性溶液: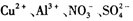 |
C.加入苯酚显紫色的溶液: |
D.加入铝粉有H2生成的溶液中: |
A、B、C、D、E五种中学常见物质均含有同一种元素,且A为单质,有如图2所示的转化关系。则下列分析中不正确的是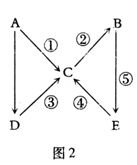
A.若ABCDE中同一种元素的价态均不相同,则A为非金属单质
B.若A为金属钠,则由1mol D完全反应生成C时,一定有1mol电子转移
C.若A为非金属硫,则④的反应类型既可能为氧化还原反应,也可能为非氧化还原反应
D.若A为金属铁,则化合物C和D均可以由化合反应制得
设NA为阿伏加德罗常数的值,下列有关叙述正确的是
| A. 1mol羟基与17 g NH3所含电子数均为NA |
| B.标准状况下,1mol HF的体积约为22.4 L |
| C.电解精炼铜的过程中,每转移NA个电子时,阳极溶解铜的质量小于32g |
D. 10 L 0.1 mol/L的Na2CO3溶液中,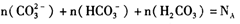 |