(15分) 某同学设计了如下图所示装置(部分夹持装置已略去),该装置可以用来进行多项
实验研究。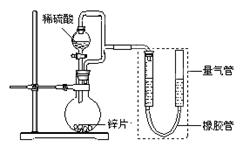
请回答:
(1)用上述装置探究影响化学反应速率的因素。
①圆底烧瓶中发生反应的离子方程式是 。
②用上述装置进行实验,以生成9.0 mL气体为计时终点,结果为t1>t2。
| 序号 |
V(H2SO4)/mL |
c(H2SO4)/mol·L-1 |
t/s |
| Ⅰ |
40 |
1 |
t1 |
| Ⅱ |
40 |
4 |
t2 |
比较实验Ⅰ和Ⅱ可以得出的实验结论是 。
③若将锌片换成含杂质的粗锌片,且控制其他条件使其与上述实验完全一致,所测得的反应速率均大于上述实验对应的数据。粗锌片中所含杂质可能是(填序号) 。
a.石墨 b.银 c.铜 d.沙粒(二氧化硅)
(2)用上述装置测定粗锌片的纯度。
①连接好装置,检查装置气密性,称量粗锌片mg置于圆底烧瓶中,滴加足量稀硫酸,充分反应直至不再产生气体为止,测得气体体积为VL,则粗锌片的纯度为 。
②本实验在读数前对量气管的操作是 。
③本套装置中若考虑滴入的稀硫酸的体积(假设其它操作都正确),则测得的气体的体积将 。(填“偏大”、“偏小”或“无影响”,)
(3)用上述装置验证生铁在潮湿空气中会发生吸氧腐蚀。
①圆底烧瓶中的试剂可选用(填序号) 。
a.NH4Cl溶液 b.C2H5OH c.Na2CO3溶液 d.稀硫酸
②能证明生铁在潮湿空气中会发生吸氧腐蚀的现象是 。
用硝酸氧化淀粉水解的产物(C6H12O6)可制得少量草酸,装置如图A所示(加热、搅拌和仪器固定装置均已略去):已知硝酸氧化淀粉水解液过程中可发生下列反应: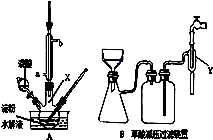
C6H12O6+12HNO3→3H2C2O4+9NO2↑+3NO↑+9H2O
C6H12O6+8HNO3→6CO2+8NO↑+10H2O
3H2C2O4+2HNO3→6CO2+2NO↑+4H2O
实验过程如下:
将1∶1的淀粉水乳液与少许硫酸(98%)加入烧杯中,
水浴加热至85℃~90℃,保持30 min,然后逐渐将温度降至60℃左右;
②将一定量的淀粉水解液加入容器X中;
③控制反应液温度在55~60℃条件下,边搅拌边缓慢滴加一定量含有适量催化剂的混酸(65%HNO3与98%H2SO4的质量比为2:1.5)溶液;
④反应3h左右,冷却,减压过滤后再重结晶得草酸晶体。
请回答下列问题:
(1)容器X的名称:。
(2)冷凝管水的进口是(填a或b);冷凝管冷凝回流的主要物质是 。
(3)实验中若混酸滴加过快,将导致草酸产量下降,其原因是。
(4)该装置最大的一个缺点是 。
(5)草酸重结晶的减压过滤装置如图B。仪器Y接在水龙头上,其作用是 。
减压过滤的操作有:①将含晶体的溶液倒入漏斗;②将滤纸放入漏斗并用水湿润;③打开水龙头;④关闭水龙头;⑤拆下橡皮管。正确的顺序是 。
(6) 将产品在恒温箱内约90℃以下烘干至恒重,得到二水合草酸。用KMnO4标准溶液滴定,该反应的离子方程式为:
2MnO4-+ 5H2C2O4 + 6H+ = 2Mn2++ 10CO2↑+ 8H2O
称取该样品0.12 g,加适量水完全溶解,然后用0.020 mol·L-1
的酸性KMnO4溶液滴定至终点(杂质不参与反应),此时溶液
颜色由变为。滴定前后滴定管中的液面读数如图所
示,则该草酸晶体样品中二水合草酸的质量分数为。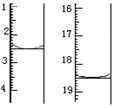
黄铁矿在高温时和氧气反应生成氧化铁和二氧化硫(假设矿石中的杂质不参与化学反应)。某化学学习小组对黄铁矿样品进行如下实验探究:
【实验一】测定硫元素的含量
I.实验装置如下图所示(夹持和加热装置省略)。A中的试剂是双氧水,将m1g该黄铁矿样品放入硬质玻璃管D中。从A向B中逐滴滴加液体,使气体发生装置不断地缓缓产生气体,高温灼烧硬质玻璃管中的黄铁矿样品至反应完全。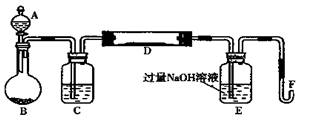
II.反应结束后,将E瓶中的溶液进行如下处理:
【实验二】测定铁元素的含量
III.测定铁元素含量的实验步骤如下:
① 用足量稀硫酸溶解硬质玻璃管D中的固体残渣;
② 加还原剂使溶液中的Fe3+完全转化为Fe2+后,过滤、洗涤;
③ 将滤液稀释至250 ml;
④ 每次取稀释液25.00 ml,用已知物质的量浓度为c mol/L的酸性KMnO4溶液滴定,三次滴定实验所需KMnO4溶液体积的平均值为V ml。
请回答下列问题:
(1)仪器B中发生反应的化学方程式是;仪器C中装入的试剂是。E瓶的作用是。
(2)II中加入H2O2发生反应的离子方程式。
(3)III的步骤③中,需要用到的仪器除烧杯、玻璃棒外,还必须要有;④中取稀释液25.00 ml需用的仪器是。
(4)假设在整个实验过程中硫元素和铁元素没有损失,则该黄铁矿样品中硫元素的质量分数为。(用含m1和m2的代数式表示);该黄铁矿中铁元素的质量分数为。(用含m1、c、V的代数式表示)
为了证明稀硝酸与铜反应的气体产物是NO,某同学设计了如下实验装置和实验方案。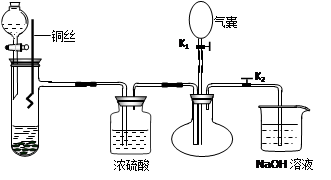
实验步骤:
⑴关闭K1,打开K2,向试管中加石灰石,通过分液漏斗向其中加入一定的稀硝酸,则加入石灰石的作用是______________________________________________________,
反应化学方程式是。
⑵将将铜丝插入稀硝酸中,微热大试管。
该步反应离子方程式是。
⑶充分反应后,打开开关K1,通过气囊鼓入空气,可以观察到烧瓶中,证明稀硝酸与铜反应的气体产物是NO。
⑷NaOH溶液的作用。
某化学研究性学习小组拟对一种焰火原料(由两种短周期的常见金属单质组成的合金粉末)进行探究。请完成下列探究报告。
【探究目的】探究该焰火原料的组成
【资料检索】① Mg2+检验方法:取2滴待检液,加入2滴2 mol·L-1 NaOH溶液,再加入1滴镁试剂(Ⅰ)染料(对硝基苯偶氮苯二酚)。若出现沉淀并吸附镁试剂(Ⅰ)染料呈天蓝色,表示待检液中含有Mg2+。Ag+、Cu2+、Fe3+、NH会妨碍Mg2+检出。
② Mg(OH)2可溶于浓的氯化铵溶液,其他的常见不溶碱难溶于氯化铵。
③很多合金是金属互化物,有确定的化学组成。
【探究思路】①确定焰火原料所含金属种类;②测定焰火原料的化学式。
【实验探究】
(1)甲同学设计实验方案,确定焰火原料中的金属种类,实验记录如下。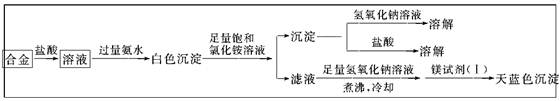
由甲的实验记录可知,该焰火原料是由________和________两种金属组成的合金;实验中滤液加入足量氢氧化钠溶液后需煮沸,煮沸的理由是 。
(2)乙同学利用甲同学的结论,设计如下图所示的实验步骤,确定合金组成。
问题讨论:
①能确定合金组成的数据组有________。(填字母)
A. m、n B. m、y C. n、y
②若合金中相对原子质量较小的金属的物质的量分数为x,金属总物质的量为7 mol,试在下图中作出y随x变化的曲线。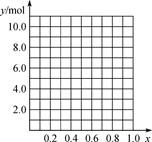
③当y=8.5 mol时,该合金是一种金属互化物,其化学式为________________。
50 mL 0.50 mol/L盐酸与50 mL 0.55 mol/L NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题: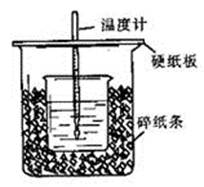
(1)从实验装置上看,图中尚缺少的一种玻璃用品是___________________________。
(2)25℃,101kPa时,1mol稀硫酸与氢氧化钠稀溶液完全反应生成液态水放出114.6kJ的热量,表示该反应中和热的热化学方程式为________________________________________。
(3)大烧杯上如不盖硬纸板,求得的中和热数值__________________(填“偏大”、“偏小”、“无影响”)。
(4)实验中改用60 mL 0.50 mol/L盐酸跟50 mL 0.55 mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量_________(填“相等”、“不相等”),所求中和热_________(填“相等”、“不相等”),简述理由___________________ _________________。
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会___________________________;用50 mL 0.50 mol/L NaOH溶液进行上述实验,测得的中和热的数值会____________ ______。(均填“偏大”、“偏小”、“无影响”)