用NA表示阿伏加德罗常数的值.下列叙述中不正确的是
| A.分子总数为NA的SO2和CO2混合气体中含有的原子数为3NA |
| B.28 g乙烯和环丁烷(C4H8)的混合气体中含有的氢原子数为4NA |
| C.常温常压下,92 g的NO2和N2O4混合气体含有的氧原子数为4 NA |
D.标准状况下,22.4L氧气与足量铁粉充分反应,转移的电子数为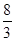 NA NA |
已知反应 X+Y = M+N为放热反应,对该反应的下列说法正确的是 ()
| A.X和Y的总能量一定高于M和N的总能量 |
| B.Y的能量一定高于N |
| C.X的能量一定高于M |
| D.因该反应为放热反应,故不必加热就可发生反应 |
量热计直接测出的是 ()
| A.质量的变化 | B.能量的变化 |
| C.温度的变化 | D.电流的变化 |
下列各项与反应热的大小无关的是()
| A.反应物的状态 | B.生成物的状态 |
| C.反应物的多少 | D.表示反应热的单位 |
下列关于纳米材料的叙述中,错误的是()。
| A.包括纳米颗粒和颗粒间界面两部分 |
| B.纳米材料属于晶体 |
| C.纳米材料属于非晶体 |
| D.同一种金属元素构成的纳米材料与宏观金属晶体具有完全等同的性质 |
电子表.电子计算器.电脑显示器都运用了液晶材料显示图像和文字。有关其显示原理的叙述中,正确的是()
| A.施加电场时,液晶分子垂直于电场方向排列 |
| B.移去电场后,液晶分子恢复到原来状态 |
| C.施加电场时,液晶分子恢复到原来状态 |
| D.移去电场后,液晶分子沿电场方向排列 |