X、Y、Z、W是元素周期表中原子序数依次增大的四种短周期元素,其相关信息如下表:
| 元素 |
相关信息 |
| X |
啤酒和饮料中常溶有X的最高价氧化物,打开瓶子时,这种氧化物会大量逸出 |
| Y |
Y2是空气中含量最高的气体单质 |
| Z |
Z的基态原子最外层电子排布式为2s22p4 |
| W |
W的一种核素质量数为27,中子数为14 |
(1)W位于元素周期表第 周期第 族;Z和W的最简单的离子半径大小关系为
(用离子符号表示)
(2)一种X形成的单质,是自然界硬度最大的物质,若熔化这种单质,所需克服的微粒间的作用力是 ;Y的电负性比Z (填“大”或“小”)
(3)W的单质与NaOH溶液反应的离子方程式为 , W在高温条件下可还原高熔点的金属氧化物制的金属单质,写出W还原Cr2O3反应的化学方程式: 。
(4)煤燃烧产生的烟气中有Y的氧化物,会引起严重的环境问题,因此,常用XH4催化还原以消除污染,已知:
XH4(g)+2 YO2(g)="=" Y2(g)+ XO2(g)+2H2O (g) △H1= -867kJ/mol
2 YO2(g) Y2O4(g) △H2=-56.9kJ/mol
Y2O4(g) △H2=-56.9kJ/mol
除去NaHCO3溶液中混有的少量Na2CO3可采取的方法是( )
| A.通入二氧化碳气体 | B.加入氢氧化钡溶液 |
| C.加入澄清石灰水 | D.加入稀盐酸 |
将0.01 mol下列物质分别加入100 mL蒸馏水中,恢复至室温,所得溶液中阴离子浓度的大小顺序是(溶液体积变化忽略不计)
①Na2O2 ②Na2O ③Na2CO3 ④NaCl
| A.①>②>③>④ | B.①>②>④>③ |
| C.①=②>③>④ | D.①=②>③=④ |
下列各组物质相互混合反应后,既有气体生成,最终又有沉淀生成的是( )
①金属钠投入到FeCl3溶液中 ②过量NaOH溶液和明矾溶液混合 ③少量Ca(OH)2投入过量NaHCO3溶液中 ④Na2O2投入FeCl2溶液中
| A.只有①④ | B.只有③ | C.只有②③ | D.只有①③④ |
钾(K)与Na在性质上具有很大的相似性,但K比Na的活泼性强,下面是根据Na的性质对K的性质的预测,其中正确的是( )
| A.K是银白色金属,硬度大,熔点高 |
| B.K在空气可以被空气中的氧气所氧化,且产物只有K2O |
| C.K与水能够反应,但不如Na与水的反应剧烈,产物都有氢气 |
| D.K也可以与氯气反应,且比Na与氯气的反应剧烈 |
工业上以铬铁矿(主要成分为FeO·Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠
(Na2Cr2O7·2H2O),其主要反应:( )
①4FeO·Cr2O3+8Na2CO3+7O2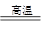 8Na2CrO4+2Fe2O3+8CO2 ②2Na2CrO4+H2SO4
8Na2CrO4+2Fe2O3+8CO2 ②2Na2CrO4+H2SO4 Na2SO4+Na2Cr2O7+H2O
Na2SO4+Na2Cr2O7+H2O
下列说法不正确的是( )
| A.反应①和②均为氧化还原反应 |
| B.Na2Cr2O7在碱性条件下可转化为Na2CrO4 |
| C.高温下,O2的氧化性大于Fe2O3和Na2CrO4的 |
| D.生成1 mol Na2Cr2O7时转移电子的物质的量大于7 mol |