某校化学兴趣小组的同学为研究铜与浓硫酸的反应,分别设计了如下图所示的三套实验装置: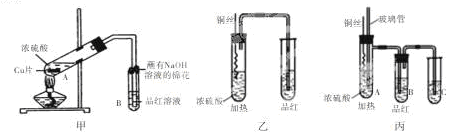
(1)该小组同学对这三套装置进行了评价,认为甲和乙装置各有优缺点,甲装置的优点是 ,乙装置的优点是 。
(2)丙装置综合了甲和乙的优点,是一套比较合理的装置,试管C中是 溶液,A中玻璃管可起到防止B中品红溶液倒吸的作用,其原理是 。
为使装置中残留气体完全被C溶液吸收,可采取的操作是 。
(3)写出丙装置中发生反应的化学方程式: ,该小组同学用丙装置进行实验过程中发现除了课本上描述的实验现象外,试管A内还生成了白色固体,白色固体成分可能是 。
(17分)黄铜矿是工业炼铜的主要原料,其主要成分为CuFeS2,现有一种天然黄铜矿(含少量脉石SiO2),为了测定该黄铜矿的纯度,某同学设计了如下实验:
称取研细的黄铜矿样品1.150g,在空气存在的条件下进行煅烧。实验后取d中溶液的1/10置于锥形瓶中,用0.05mo1/L标准碘溶液进行滴定,初读数为0.10mL,终读数如右上图所示。
(1)黄铜矿煅烧的反应为8CuFeS2+21O2高温8Cu+4FeO+2Fe2O3+16SO2,该反应中被还原的元素是___(填元素符号)。
(2)标准碘溶液应盛放在(填“碱式”或“酸式”)________滴定管中;装液之前,滴定管要用标准碘溶液润洗2—3次,润洗的操作是:。请用化学方程式表示滴定的原理:。
(3)滴定终点的读数为mL;通过计算可知,该黄铜矿的纯度为。
(4)若去掉c装置,会使测定结果(填“偏低”“偏高”或“无影响”)。
(5)假设实验操作均正确,测得黄铜矿的纯度偏低,可能的原因主要有。
利用钛白工业的副产品FeSO4(含TiO2+、Al3+)可以生产电池级高纯超微细草酸亚铁。其工艺流程如下:
(1)检验FeSO4是否已有部分氧化的方法是。
(2)已知过滤1得到的滤渣的主要成分是Al(OH)3、H2TiO3。请补充化学方程式:
TiOSO4 +=H2SO4 + H2TiO3↓;铁粉的作用有:①除去溶液中的Fe3+,②。
(3)沉淀反应的离子方程式是。
(4)沉淀过程的反应温度为40℃,温度不宜过高的原因除了控制沉淀的粒径外,还有。FeC2O4生成后,为提高产品纯度,还需调节溶液pH=2,若pH过低,则导致FeC2O4的产率______(填“偏高”、“偏低”或“无影响”)。
(5)过滤2得到的滤液经蒸发浓缩、、洗涤可得到副产品,该物质可用作(写出一种用途)。
(16分)亚硝酸钠被称为工业盐,在漂白、电镀等方面应用广泛。以木炭、浓硝酸、水和铜为原料生成的一氧化氮与过氧化钠反应制备亚硝酸钠的装置如下图所示。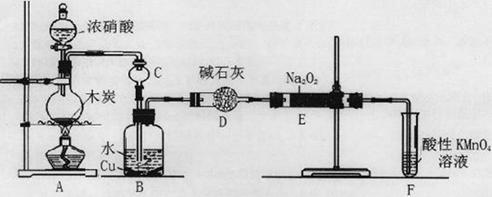
已知:室温下,① 2NO+Na2O2=2NaNO2;②酸性条件下,NO或NO2—都能与MnO4—反应生成NO3—和Mn2+,5NO2— + 2MnO4—+ 6H+=5NO3—+ 2Mn2++ 3H2O。
(1)A中观察到的现象__________________________。
(2)装置B中反应的离子方程式有____________________,_____________________。
(3)装置C的作用:____________________,装置F的作用:___________________。
(4)若无装置D,则E中产物除亚硝酸钠外还含有副产物________________________。(填化学式)
(5)NaNO2有像食盐一样的咸味,但能引起中毒。已知亚硝酸钠能发生如下反应:2NaNO2+4HI=2NO+I2+2NaI+2H2O,根据上述反应,可以用试剂和生活中常见的物质进行实验,以鉴别亚硝酸钠和食盐。进行实验时,必须选用的物质有__________________。
| A.自来水 | B.碘化钾淀粉试液 | C.淀粉 | D.白糖 E.食醋 F.白酒 |
(6)充分反应后,某同学设计实验对E中NaNO2的含量进行检测。称取E中固体2g,完全溶解配制成溶液100 ml,取出25 ml溶液用0.100 mol/L酸性KMnO4溶液进行滴定(杂质不与KMnO4反应),消耗KMnO4溶液20ml,求样品中亚硝酸钠的质量分数(保留小数点后1位)(已知:NaNO2摩尔质量69g/mol)
实验室模拟合成氨和氨催化氧化的流程如下: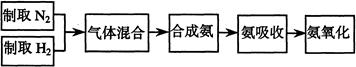
(1)已知实验室可用饱和亚硝酸钠(NaNO2)溶液与饱和氯化铵溶液经加热后反应制取氮气,该反应中只有氮元素发生变价,写出该反应的化学方程式。从下图中选择制取氮气的合适装置。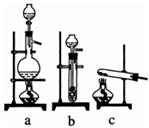
(2)氮气和氢气通过甲装置,甲装置的作用除了将气体混合外,还有。
(3)用乙装置吸收一段时间氨后,再通入空气,同时将经加热的铂丝插入乙装置的锥形瓶内,能使铂丝保持红热的原因是:,锥形瓶中还可观察到的现象是:。
(4)反应结束后锥形瓶内的溶液中含有H+、OH-、离子。
氮化铝(AlN)是一种新型无机材料。某氮化铝(AlN)仅含有Al2O3杂质,某学习小组为测定该氮化铝样品中AlN的纯度,查阅资料得知:AlN + NaOH + 3H2O = Na[Al(OH)4] + NH3↑。设计如下2种方案。
方案一:量气法——如图所示。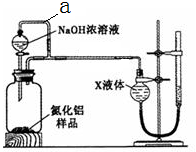
(1)按图连接好装置,检查装置气密性的方法是。
(2) 导管a的主要作用是。
(3)为测定生成气体的体积,量气装置中的X液体可以是:。(填标号)
| A.CCl4 | B.H2O | C.NH4Cl溶液 | D.植物油 |
(4)若取m g样品与NaOH浓溶液完全反应后,测得生成气体的体积为V mL(标准状况)。则样品中AlN的纯度为___________。
方案二:重量法——如下图所示。
(5)步骤①中,氧化铝与氢氧化钠溶液反应的离子方程式为_______________。
(6)样品中AlN的纯度为___________。
(7)若测得样品中AlN的纯度偏高,可能的原因是___________。(写1点)