下列图示与对应的叙述相符的是
| A.图I表示盐酸滴加到0.1mol/L某碱溶液得到的滴定曲线,用已知浓度盐酸滴定未知浓度该碱时最好选取酚酞作指示剂 |
B.图II表示一定条件下进行的反应2SO2 +O2 2SO3各成分的物质的量变化,t2时刻改变的条件可能是缩小容器体积 2SO3各成分的物质的量变化,t2时刻改变的条件可能是缩小容器体积 |
| C.图III表示某明矾溶液中加入Ba(OH)2溶液,沉淀的质量与加入Ba(OH)2溶液体积的关系,在加入20mL Ba(OH)2溶液时铝离子恰好沉淀完全 |
| D.图IV表示pH相同的盐酸与醋酸中分别加入水后溶液pH的变化,其中曲线a对应 的是盐酸 |
下列仪器选择正确的是
| A.用碱式滴定管量取17.12 mL KMnO4溶液 |
| B.用50mL量筒量取7.5mL浓盐酸 |
| C.蒸发结晶操作中须使用到坩埚、玻璃棒、酒精灯等 |
| D.过滤操作时须使用到玻璃棒、烧杯和漏斗等玻璃仪器 |
下列判断正确的是
| A.含有共价键的化合物一定是共价化合物 |
| B.晶体中一定存在化学键 |
| C.含有离子键的化合物一定是离子化合物 |
| D.金属键越强,金属越活泼,金属熔点越高 |
短周期金属元素甲-戊在元素周期表中的相对位置如表所示,下列判断正确的是
| 甲 |
乙 |
|
| 丙 |
丁 |
戊 |
| A.原子半径:丙<丁<戊 | B.第一电离能:甲>丙 |
| C.电负性:丙>丁>戊 | D.最外层电子数:甲>乙 |
下列判断错误的是
A.沸点:NH3>PH3>AsH3 |
B.碱性:NaOH>Mg(OH)2>Al(OH)3 |
| C.酸性:HClO4>H2SO4>H3PO4 | D.熔点:SiC>NaCl>SiCl4 |
下列有关物质结构的表述正确的是
A.次氯酸的电子式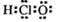 |
B.二氧化硅的分子式SiO2 |
C.硫原子 的最外层电子排布式为3s23p4 的最外层电子排布式为3s23p4 |
D.钠离子的结构示意图为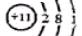 |