X、Y、Z、W是短周期的四种元素,有关它们的信息如下表所示。
| 元素 |
部分结构知识 |
部分性质 |
| X |
X原子核外电子占有9个原子轨道 |
X的一种氧化物是形成酸雨的主要物质 |
| Y |
Y原子的次外层电子数等于最外层电子数的一半 |
Y能形成多种气态氢化物 |
| Z |
Z原子的最外层电子数多于4 |
Z元素的最高正化合价与最低负化合价代数和等于6 |
| W |
W原子的最外层电子数等于2n-3(n为原子核外电子层数) |
化学反应中W原子易失去最外层电子形成Wn+ |
填写下列空白:(提示:不能用字母X、Y、Z、W作答)
(1)X有多种同素异形体,写出X2电子式是 ,
(2)X、Y、Z三种元素电负性由大到小顺序为_____。
(3)W元素原子基态时原子的电子排布式_________________。
(4)Z位于元素周期表第 周期第 族
(5)含W的一种硫酸盐是常用的净水剂,常温时该溶液的pH (填“=”、“>”或“<”),理由是: (用离子方程式表示)。
(6).25℃、101 kPa时,32 g Y的最低价气态氢化物完全燃烧生成稳定的氧化物时放出1780.6 kJ的热量,写出该反应的热化学方程式 。
在25℃时,有pH为a的HCl溶液和pH为b的NaOH溶液,取VaL该盐酸溶液用该NaOH溶液中和,需VbL NaOH 溶液,问:
(1)若a+b=14,则Va/Vb=.
(2)若a+b=13,则Va/Vb=
(3)若a+b>14,则Va/Vb=,且VaVb(填“>”“<”“=”)
(题中a≤b,b≥8)。
在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力如图所示。请回答: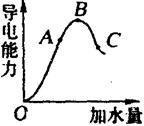
(1)“O”点导电能力为“0”的理由是_______________________。
(2)A、B、C三点pH值由大到小的顺序是_______________________。
(3)A、B、C三点电离度最大的是____________________。
在95℃时,纯水的pH(填“大于”“小于”“等于”)7,所选择的理由是。
(共12分)
(1)以CO2为碳源制取低碳有机物一直是化学领域的研究热点,CO2加氢制取低碳醇的反应如下:
反应I:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H=-49.0kJ/mol
反应II:2CO2(g)+6H2(g)=CH3CH2OH(g)+3H2O(g) △H=-173.6kJ/mol
写出由CH3OH(g)合成CH3CH2OH(g)的反应的热化学方程式_______________
(2)高铁酸钾(K2FeO4)是铁的一种重要化合物,具有极强的氧化性
①电解法是工业上制备K2FeO4的一种方法。以铁为阳极电解氢氧化钠溶液,然后在阳极溶液中加入KOH。电解时阳极发生反应生成FeO42-,该电极反应式为_________________
②与MnO2—Zn电池类似,K2FeO4—Zn也可以组成碱性电池,K2FeO4在电池中作正极材料,其电极反应式为FeO42-+3e-+4H2O=Fe(OH)3+5OH-,则该电池总反应的离子方程式为__________________
(3)amol FeS与bmol FeO投入到VL、C mol/L的硝酸溶液中充分反应产生NO气体,所得澄清溶液成分可看作是Fe(NO3)3、H2SO4的混合液,则反应中未被还原的硝酸可能为_____
①(a+b)×63g②(a+b)×189g③(a+b)mol④VC- mol
mol
工业上金属的冶炼过程复杂。
(1)炼铁涉及的2个热化学方程式:
Fe2O3(S)+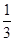 CO(g)=
CO(g)= 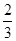 Fe3O4(S)+
Fe3O4(S)+ 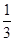 CO2(g)∆H=-15.73kJ•mol-1
CO2(g)∆H=-15.73kJ•mol-1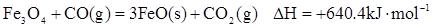
则反应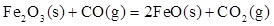 的
的 。
。
(2)工业上电解硫酸锌溶液可实现湿法炼锌(控制条件,使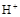 难放电、阳极电极不溶解)。写出电解总方程式。
难放电、阳极电极不溶解)。写出电解总方程式。
(3)将干净的铁片浸于熔融的液态锌水中可制得镀锌钢板,这种钢板具有很强的耐腐蚀能力。镀锌钢板的镀层一旦被破坏后,锌将作为原电池的极发生
反应。(填“氧化”或“还原”)
(4)实验室用镀锌钢板与稀硫酸制取标准状况下的氢气4.48L,则该反应转移的电子数为,消耗硫酸的物质的量是。