由苯乙烯经下列反应可制得F、K两种高分子化合物,它们都是常用的塑料。
(1)J中所含官能团的名称为 ;K中所含官能团的结构简式为
(2)聚合物F的结构简式是 ;I的分子式是 。
(3)E转化为G的化学方程式是 ;反应类型属于
(4)在一定条件下,两分子J能脱去两分子水形成一种六元环状化合物,写出该化合物的结构简式 。
(5)写出J 的一种符合下列条件的同分异构体X结简式 。
①1mol X可以与3mol NaOH反应 ②X分子中氢原子核磁共振氢谱有4个峰,
(10分)对于A+2B(气)  nC(气)+Q在一定条件下达到平衡后,改变下列条件,请回答:
nC(气)+Q在一定条件下达到平衡后,改变下列条件,请回答:
(1)A量的增减,平衡不移动,则A为______态。
(2)增压,平衡不移动,当n=2时,A的状态为________;当n=3时,A的状态为______。
(3)若A为固体,增大压强,C的组分含量减少,则____。
(4)升温,平衡向右移动,则该反应的逆反应为________反应。
在100℃时,将0.200 mol的四氧化二氮气体充入2L抽空的密闭容器中,每隔一定时间对该容器内的物质进行分析,得到如下表格:
| 时间 |
0 |
20 |
40 |
60 |
80 |
100 |
| c(N2O4) |
0.100 |
c1 |
0.050 |
c3 |
a |
b |
| c(NO2) |
0.000 |
0.060 |
c2 |
0.120 |
0.120 |
0.120 |
试填空:
(1)该反应的化学方程式为_________________________________,达到平衡时四氧化二氮的转化率为________%。
(2)20s时四氧化二氮的浓度c1=________mol·L-1,在0~20s时间段内,四氧化二氮的平均反应速率为________mol•L-1•s-1。
(3)若在相同情况下最初向容器中充入的是二氧化氮气体,要达到上述同样的平衡状态,二氧化氮的初始浓度为________mol•L-1。
根据下列叙述写出相应的热化学方程式:
(1)已知16 g固体硫完全燃烧时放出148.4 kJ的热量,该反应的热化学方程式是
________________________________________________________________________
(2)图是198 K时N2与H2反应过程中能量变化的曲线图。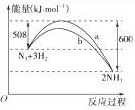
该反应的热化学方程式为:_____________________________________________________
(3)写出以下物质的电离方程式:
NaHCO3__________________________________________,
CH3COONH4_____________________________________,
H2CO3_____________________________________________
判断下列说法是否正确(正确的在括号内打“√”错误的打“×”)
①中和等体积、等物质的量浓度的盐酸和醋酸溶液,盐酸所需氢氧化钠少于醋酸;()
②将NaOH和氨水溶液各稀释一倍,两者的OH-浓度均减少到原来的 ;()
;()
③如果盐酸的浓度是醋酸浓度的二倍,则盐酸的H+浓度也是醋酸的二倍;()
④物质的量相同的磷酸钠溶液和磷酸溶液中所含的PO3-4量相同。()
下列盐溶液能发生水解的用离子方程式表示,不能发生水解的写“不发生水解”字样,并说明溶液的酸碱性
K 2CO3, 溶液呈性;
Na2SO4, 溶液呈性;
CuCl2, 溶液呈性。