利用下图密封装置进行实验,起初a、b两处液面相平,放置一段时间。下列说法正确的是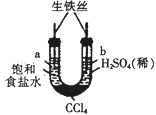
| A.a中发生析氢腐蚀,b中发生吸氧腐蚀 |
| B.一段时间后,a中液面低于b中液面 |
| C.a中溶液的pH增大,b中溶液的pH减小 |
| D.a、b中负极的电极反应式均为Fe-2e-=Fe2+ |
实验室制取干燥的下列气体,收集方法和使用的干燥剂可以完全相同的是
| A.H2和CO2 | B.CO2和O2 | C.Cl2和NH3 | D.NH3和O2 |
室温时,在体枳相同日的容器内混合下列气体。混合后压强最小的是
| A.100mL H2和50mL O2 | B.100mL HCl和100mL NH3 |
| C.100mL NO和100mL O2 | D.100mL N2和200mL O2 |
下列叙述不正确的是
| A.钠燃烧时发出黄色火焰 |
| B.在常温下,铝不能与氧气反应 |
| C.常温下可以用铁罐装运浓硫酸 |
| D.为了检验某FeCl2溶液是否变质,可向溶液中加入KSCN溶液 |
把铁片放入下列溶液中.铁片溶解,溶液质量增加,但没有气体放出的是
| A.稀硫酸 | B.CuSO4溶液 | C.Fe2(SO4)3溶液 | D.AgNO3溶液 |
下列反应中,能用离子方程式H++OH-=H2O表示的是
| A.NaOH溶液和H2SiO3溶液混合 | B.Ba(OH)2溶液和盐酸混合 |
| C.Al(OH)3和稀H2SO4反应 | D.氨水和硫酸反应 |