常温下,向物质的量浓度均为0.1mol·L-1的盐酸和氯化钙的混合溶液中逐滴加入0.1mol/L碳酸钠溶液至沉淀刚好完全。下图中关系正确的是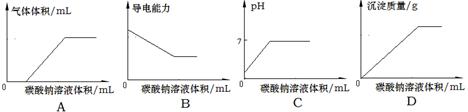
下列根据实验操作和现象所得出的结论正确的是
| 选项 |
实 验 操 作 |
实验现象 |
结论 |
| A |
向两份蛋白质溶液中分别滴加饱和NaCl溶液和CuSO4溶液 |
均有固体析出 |
蛋白质均发生变性 |
| B |
将一定量的NaNO3和KCl混合液加热浓缩至有固体析出,过滤 |
得到白色晶体 |
白色晶体为KNO3 |
| C |
向某FeCl2溶液中,加入Na2O2粉末 |
得红褐色沉淀 |
原FeCl2已氧化变质 |
| D |
向浓度均为0.1 mol/L NaCl和NaI混合溶液中滴加少量AgNO3溶液 |
出现黄色沉淀 |
Ksp(AgCl) > Ksp(AgI) |
下列说法中正确的是
| A.生成物总能量一定低于反应物总能量 |
B.同温同压下,H2(g)+Cl2(g)=2HCl(g) 在光照和点燃条件下的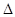 H不同 H不同 |
C.一定条件下,0.5 mol N2和1.5 mol H2置于某密闭容器中充分反应生成NH3气,放热19.3 kJ,其热化学方程式为N2(g)+3H2(g) 2NH3(g) 2NH3(g) 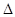 H =-38.6 kJ/mol H =-38.6 kJ/mol |
| D.一定条件下4 HCl(g)+O2(g)=2Cl2(g)+2H2O(g) ,当1 mol |
O2 反应放出115.6 kJ热量,键能如下表所示,则断裂1 mol
H-O键与断裂1 mol H-Cl键所需能量差为31.9 kJ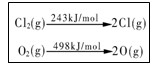
已知X、Y、Z、W为短周期主族元素,在周期表中的相对位置如图所示,下列说
法正确的是
| X |
Y |
| Z |
W |
A.若四种元素均为非金属,则W的最高价氧化物对应的水化物一定是强酸
B.若HmXOn为强酸,则X的氢化物溶于水一定显酸性(m、n均为正整数)
C.若四种元素均为金属,则Z的最高价氧化物对应的水化物一定为强碱
D.若四种元素中只有一种为金属,则Z与Y的最高价氧化物对应的水化物能反应
下列有关化学概念或原理的论述中,正确的是
| A.任何一个氧化还原反应都可以设计为电池,输出电能 |
| B.铅蓄电池放电时的负极和充电时的阴极均发生氧化反应 |
| C.电解饱和食盐水的过程中,水的电离平衡正向移动 |
| D.任何可逆反应,其平衡常数越大,反应速率、反应物的转化率就越大 |
下列离子方程式正确的是
| A.氨气通入醋酸溶液:CH3COOH+NH3=CH3COONH4 |
B.亚硫酸氢钠溶液呈酸性:HSO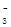 +H2O +H2O H3O++SO H3O++SO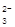 |
| C.氢氧化铁溶于氢碘酸中:Fe(OH)3+3H+=Fe3++3H2O |
D.稀硝酸洗涤试管内壁的银镜:Ag+2H++NO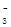 =Ag++NO↑+H2O =Ag++NO↑+H2O |