下列有关说法不正确的是(NA表示阿伏加德罗常数)( )
| A.向硫酸酸化的KMnO4溶液中滴加BaCl2溶液,会产生白色沉淀和黄绿色气体 |
| B.室温下,42.0g乙烯和丁烯的混合气体中含有的碳原子数为3NA |
| C.CO32-离子的VSEPR模型为平面三角形 |
| D.19.5gNa2O2投入过量的水中,反应中转移的电子数为0.5NA |
通过NO传感器可监测NO的含量,其工作原理如图所示。下列说法错误的是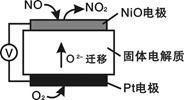
| A.该装置实现化学能向电能的转化 |
| B.该电池的总反应为2NO + O2 = 2NO2 |
| C.NiO电极的电极反应式: NO + O2- - 2e—= NO2 |
| D.当有2.24L的O2参与反应时,转移了0.4mole— |
某离子反应中涉及H2O、ClO-、NH4+、H+、N2、Cl-六种微粒。其中N2、ClO-的物质的量随时间变化的曲线如图所示。下列判断不正确的是
| A.该反应的氧化剂是ClO- |
| B.消耗1 mol还原剂,转移3 mol电子 |
| C.氧化剂与还原剂的物质的量之比为2:3 |
| D.反应后溶液的酸性明显增强 |
由一种阳离子和两种酸根离子组成的盐称混盐。下列关于混盐Na4S2O3的有关判断,不正确的是
| A.该混盐水溶液呈碱性 |
| B.该混盐与H2SO4反应有气体生成 |
| C.该混盐溶液加入BaCl2可以生成白色沉淀 |
| D.该混盐在酸性条件下可生成S,每产生32g S转移2NA个电子 |
氯酸是一种强酸,浓度超过40%时会发生分解,反应可表示为:a HClO3 = bO2↑+ c Cl2↑+ d HClO4 + e H2O。下列有关说法正确的是
| A.由反应可确定:氧化产物是O2 |
| B.若氯酸分解所得混合气体lmol混合气体质量为45g,则反应方程式可表示为:3HClO3 = 2O2↑+ C12↑+ HClO4 + H2O |
| C.由非金属性Cl>S,可推知酸性HClO3>H2SO4 |
| D.若化学计量数a=8,b=3,则该反应转移电子数为8e- |
把图2的碎纸片补充到图1中,可得到一个完整的氧化还原反应的离子方程式(未配平)。下列对该反应的说法不正确的是
| A.IO4-作氧化剂 |
| B.若有1 mol Mn2+参加反应转移5 mol电子 |
| C.氧化剂与还原剂的物质的量之比为5∶2 |
| D.配平后Mn2+、H+的化学计量数分别为2、3 |