达州市渠县境内含有丰富的深层地下食盐资源,食盐是日常生活中的必需品,也是重要的化工原料。
(1)经测定该县深层地下粗盐中含有少量K+、Ca2+、Mg2+、Fe3+等杂质离子,某研究性学习小组在实验室提纯NaCl的流程如下:
所提供的试剂:饱和Na2CO3溶液、饱和K2CO3溶液、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液、75%乙醇溶液、CCl4,仪器及用品自选。
①欲除去溶液中的Ca2+、Mg2+、Fe3+、SO42-,选出a操作中所代表的试剂,按滴加顺序依次为
(只填化学式),b步操作的名称是 。
②洗涤除去NaCl晶体表面附带的少量KCl,应选用试剂是 ,用PH试纸测定滤液ⅡPH值的方法是 。
(2)用提纯的NaCl配制500mL,2.5mol·L-1的NaCl溶液,所需仪器除烧杯,托盘天平(砝码和镊子),药匙,玻璃棒外,还需要 (填仪器名称),应称取NaCl g
(3)下列操作会导致所配NaCl溶液浓度偏高的是
| A.定容完毕后,盖塞,摇匀,再将容量瓶置于实验台上,发现液面低于刻度线,再添加蒸馏水至刻度线。 | |
| B.未将洗涤烧杯内壁的溶液转入容量瓶。 | C.定容时,俯视刻度线。 |
| D.转移溶液之前,容量瓶内有少量蒸馏水。 E、称量时,天平指针指向左盘。 |
实验室制取硝基苯的主要步骤如下:
①配制一定比例的浓硫酸与浓硝酸的混合液,加入反应器。
②向室温下的混合酸中逐滴加入一定量的苯,充分振荡,混合均匀。
③在50~60℃下发生反应,直到反应结束。
④除去混合酸后,粗产品依次用蒸馏水和5%的NaOH溶液洗涤,最后再用蒸馏水洗涤。
⑤将用无水CaCl2干燥后的粗硝基苯进行蒸馏得到纯硝基苯。
填写下列空白:
(1)配制一定比例的浓硫酸和浓硝酸混合酸时,操作注意事项是__________________________________________________。
(2)步骤③中,为了使反应在50~60℃下进行,常用的方法是________。
(3)步骤④中洗涤、分离粗硝基苯应使用的仪器是______________________________。
(4)步骤④中粗产品用5%NaOH溶液洗涤的目的是_________________________。
(5)纯硝基苯是无色、密度比水________(填“大”或“小”),具有________气味的油状液体。
苯和溴取代反应的实验装置如图所示,其中A为由具支试管改制成的反应容器,在其下端开了一小孔,塞好石棉绒,再加入少量铁屑粉。填写下列空白:
(1)向反应容器A中逐滴加入溴和苯的混合液,几秒内就发生反应。写出A中所发生反应的化学方程式(有机物写结构简式):____________________________。
(2)B中NaOH溶液的作用是____________________。
(3)试管C中苯的作用是_______________________。
反应开始后,观察D和E两试管,看到的现象为____________________________,此现象可以验证苯和液溴的反应为____________(填反应类型)。
已知某种气态化石燃料含有碳和氢两种元素。为了
测定这种燃料中碳和氢两种元素的质量分数,可将气态燃料放入足量的氧气中燃烧,并使产生的气体全部通入如图所示的装置,得到如表所列的实验数据(U形管中干燥剂只吸收水蒸气且假设产生的气体完全被吸收)。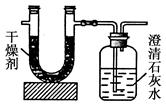
| 实验前 |
实验后 |
|
| (干燥剂+U形管)的质量 |
101.1g |
102.9g |
| (石灰水+广口瓶)的质量 |
312.0g |
314.2g |
根据实验数据求:
(1)实验完毕后,生成物中水的质量为________g。假设广口瓶里生成一种正盐,其质量为________g。
(2)生成的水中氢元素的质量为________g。
(3)生成的CO2中碳元素的质量为________g。
(4)气态化石燃料中碳元素与氢元素的质量比为________。
如图是某同学利用日常用品注射器设计简易实验装置。甲管中注入10mL CH4,同温、同压下乙管中注入50mL Cl2,将乙管气体推入甲管中,气体在甲管中反应,针管用日光照射一段时间。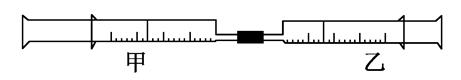
(1)下列是某同学预测的实验现象:
①气体最终变为无色;②实验过程中,甲管活塞向内移动;③甲管内壁有油珠;④产生火花。其中正确的是________。
(2)甲管中发生的化学反应类型为________。
(3)反应后,甲管中剩余气体能用下列试剂吸收的是_________
____________。
| A.水 | B.氢氧化钠溶液 |
| C.硝酸银溶液 | D.饱和食盐水 |
(4)反应后,若将甲管中的物质推入盛有适量AgNO3溶液的小试管中会观察到________,若再向其中滴入几滴石蕊试液,又观察到________________。
利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实。某化学兴趣小组在实验室中模拟上述过程,其设计的模拟装置如下: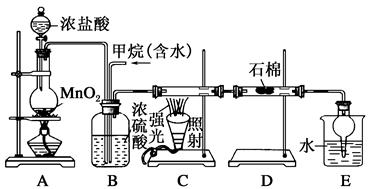
根据设计要求回答:
(1)B装置有三种功能:①控制气流速度;②均匀混合气体;③______________。
(2)设V(Cl2)/V(CH4)=x,若理论上欲获得最多的氯化氢,则x值应________。
(3)D装置的石棉中均匀混有KI粉末,其作用是____________。
(4)E装置的作用是________(填序号)。
| A.收集气体 | B.吸收氯气 |
| C.防止倒吸 | D.吸收氯化氢 |
(5)在C装置中,经过一段时间的强光照射,发现硬质玻璃管内壁有黑色小颗粒产生,写出置换出黑色小颗粒的化学方程式:_____________________________________________。
(6)E装置除生成盐酸外,还含有有机物,从E中分离出盐酸的最佳方法为________。该装置还有缺陷,原因是没有进行尾气处理,其尾气主要成分为________(填序号)。
a.CH4 b.CH3Cl c.CH2Cl2 d.CHCl3 e.CCl4