下列实验操作、现象或反应原理的解释、结论均正确的一组是
| 操作、现象 |
解释或结论 |
| A.铝箔在酒精灯火焰上加热,熔化但不滴落 |
铝箔对熔化的铝有吸附作用 |
| B.向盛有0.005mol/L FeCl3溶液的试管中加入5mL 0.01mol/LKSCN溶液,溶液呈红色,再加入5滴饱和FeCl3溶液,红色加深 |
增大反应物的浓度,化学平衡向正反应方向移动 |
| C.向淀粉溶液中加入稀硫酸,水浴加热,一段时间后,再加入新制的氢氧化铜悬浊液并加热,未见红色沉淀 |
淀粉未水解 |
| D.取某溶液少量,加入盐酸酸化的硝酸钡溶液,出现白色沉淀 |
该溶液中一定含有大量的SO42- |
有关下图所示化合物的说法不正确的是
| A.该物质的分子式是:C23H26O6 |
| B.1mol该化合物最多可以与3molNaOH反应 |
| C.既可以催化加氢,又可以使酸性KMnO4溶液褪色 |
| D.既可以与FeCl3溶液发生显色反应,也可以与Br2的CCl4溶液发生加成反应 |
现有乙酸和两种链状单烯烃混合物,其中氧的质量分数为a ,则碳的质量分数是:
A. |
B. |
C. (1-a) (1-a) |
D. (1-a) (1-a) |
将NH4I(s)置于密闭容器中,在一定温度下发生下列反应:
①NH4I(s) NH3(g)+HI(g);②2HI(g)
NH3(g)+HI(g);②2HI(g) H2(g)+I2(g)。
H2(g)+I2(g)。
达到平衡时,c(I2)=0.4mol·L-1,c(HI)=4.2mol·L-1,则此温度下反应①的平衡常数为
| A.17 | B.19 | C.21 | D.25 |
在苯和它的衍生物中, 由于侧链与苯环间的相互影响, 从而使它们在性质上都发生了一些变化。但下列反应中不能够说明这一现象的是



一定条件下,在密闭容器内,SO2氧化成SO3的热化学方程式为:2SO2 (g) + O2 (g) 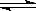 2SO3 (g);△H=-a kJ·mol-1在相同条件下,要想得到2a kJ热量,加入各物质的物质的量可能是
2SO3 (g);△H=-a kJ·mol-1在相同条件下,要想得到2a kJ热量,加入各物质的物质的量可能是
| A.4molSO2和2molO2 | B.5molSO2和3molO2 |
| C.4molSO2和4molO2 | D.2molSO2、1molO2和2molSO3. |