下列说法正确的是
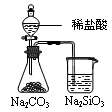
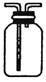
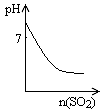
图Ⅰ 图Ⅱ 图Ⅲ 图Ⅳ
| A.图I所示装置用于Cu和浓H2SO4制取少量的SO2气体 |
| B.图Ⅱ装置可验证非金属性:Cl>C>Si |
| C.图Ⅲ可用于收集气体H2、CO2、Cl2、NH3 |
| D.图Ⅳ表示将SO2气体通入溴水中,所得溶液的pH变化 |
对于可逆反应N2(g)+3H2(g)2NH3(g)(正反应为放热反应),下列说法正确的是( )
| A.达到平衡时N2、H2、NH3的含量一定相等 |
| B.达到平衡后加入N2,当重新达到平衡时,NH3的浓度比原平衡的大,H2的浓度比原平衡的小 |
| C.达到平衡时,升高温度,加快了逆反应速率,减慢了正反应速率,所以平衡向逆反应方向移动 |
| D.加入催化剂可以缩短达到平衡的时间,是因为正反应速率加快了,逆反应速率减慢了 |
下列事实中不能应用勒夏特列原理来解释的是( )
| A.实验室常用排饱和食盐水法收集氯气 |
| B.加入催化剂有利于氨氧化的反应 |
| C.高压有利于合成氨的反应 |
| D.400~500 ℃左右比室温更有利于合成氨的反应 |
不能用化学平衡移动原理说明的事实是( )
| A.合成氨在高压下进行是有利的 |
| B.温度过高对合成氨不利 |
| C.使用催化剂能使合成氨速率加快 |
| D.及时分离从合成塔中出来的混合气,有利于合成氨 |
合成氨工业采用铁触媒作催化剂,这是因为( )
| A.能提高H2的转化率 |
| B.能提高平衡时NH3的百分含量 |
| C.能提高N2的利用率 |
| D.能加快反应速率 |
下面四个选项是四位同学在学习过化学反应速率理论和化学平衡理论以后,联系化工生产实际所发表的看法,你认为不正确的是( )
| A.化学反应速率理论可指导怎样在一定时间内快出产品 |
| B.化学平衡理论可指导怎样使用有限原料多出产品 |
| C.化学反应速率理论可指导怎样提高原料的转化率 |
| D.正确利用化学反应速率和化学平衡理论都可提高化工生产的综合经济效益 |