下列叙述正确的是( )
| A.胶体区别于其他分散系的根本原因是胶体有丁达尔效应 |
| B.分散系中分散质粒子直径由小到大的正确顺序是:溶液<胶体<浊液 |
| C.向氢氧化钠溶液中边滴加饱和FeCl3溶液边振荡制备Fe(OH)3胶体 |
| D.胶体的分散质可以通过过滤从分散剂中分离出来 |
聚乳酸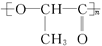 可在乳酸菌作用下分解而排除白色污染,下列有关聚乳酸的说法正确的是( )
可在乳酸菌作用下分解而排除白色污染,下列有关聚乳酸的说法正确的是( )
| A.1mol聚乳酸完全燃烧消耗O23mol |
B.聚乳酸的单体是 |
| C.聚乳酸是由单体之间通过加聚而合成的 |
| D.聚乳酸是一种酸性高分子材料 |
下列反应中属于加成反应的是( )
A乙炔通入酸性高锰酸钾溶液中,溶液褪色
B苯滴入溴水中,振荡后溴水层接近无色
C甲烷和氯气混合后,放置在光亮的地方,混合气体颜色逐渐变浅
D将裂化获得的汽油滴入溴水中,溴水褪色
有机物X可以还原成醇,也可以氧化成一元羧酸,该醇与该一元羧酸反应可生成化学式为C2H4O2的有机物,则下列结论中正确的是
| A.X具有较强氧化性 | B.X分子中含有甲基 |
| C.X的式量为30 | D.X中的含碳量为40% |
下列有机物命名不正确的是
A.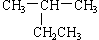 2-乙基丙烷 2-乙基丙烷 |
B.(CH3)2CHCH2CH2OH 1-戊醇 |
C. CH3- -CH3 1,4-二甲苯 -CH3 1,4-二甲苯 |
D. 2-甲基丙烯 2-甲基丙烯 |
下列说法不正确的是( )
| A.无论乙烯与丙烯酸以何种比例混合,只要二者总物质的量是个定值,完全燃烧时所消耗的氧气也一定是个定值 |
| B.鉴别甲苯、苯乙烯、苯酚、丙烯酸溶液可选用KMnO4溶液、溴水 |
| C.可以利用燃烧法来区别聚乙烯塑料和聚氯乙烯塑料、毛和棉 |
| D.装溴水、高锰酸钾溶液的试剂瓶不能用橡胶塞,因为橡胶分子中含有碳碳双键 |