在硫酸铁电化浸出黄铜矿精矿工艺中,有一主要反应:CuFeS2+4Fe3+==Cu2++5Fe2++2S,反应结束后,经处理获得单质硫x mol。下列说法正确的是 ( )
| A.反应中硫元素被氧化,所有铁元素均被还原 |
| B.氧化剂是Fe3+,氧化产物是Cu2+ |
| C.反应中转移电子的物质的量为x mol |
| D.反应结束后,测得溶液中三种金属离子的总物质的量为y mol,则原Fe3+的总物质的量为(y-x) mol |
设NA为阿伏加德罗常数的值。下列说法正确的是( )
| A.25 ℃,pH=13的NaOH溶液中,含有OH-的数目为0.1NA |
| B.1.2 g C60和石墨的混合物中,含有的碳原子数目为0.1NA |
| C.2.24 L N2和NH3的混合气体中,含有的共用电子对数目为0.3NA |
| D.标准状况下,6.72 L NO2与水充分反应转移的电子数目为0.1NA |
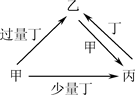
甲、乙、丙、丁均为中学化学中常见的单质或化合物,它们之间的转化关系如下图所示(部分产物已略去),下列各组物质中不能按图示关系转化的是( )
| 选项 |
甲 |
乙 |
丙 |
丁 |
| A |
NaOH |
NaHSO3 |
Na2SO3 |
SO2 |
| B |
AlCl3 |
NaAlO2 |
Al(OH)3 |
NaOH |
| C |
Fe |
Fe(NO3)3 |
Fe(NO3)2 |
HNO3 |
| D |
C |
CO |
CO2 |
O2 |
用下列装置进行相应实验,不能达到实验目的的是( )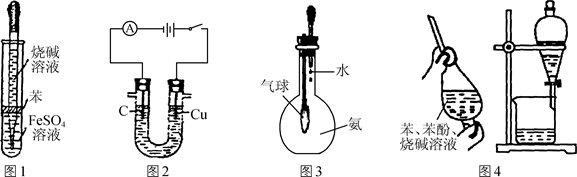
| A.图1所示装置可制备氢氧化亚铁 |
| B.图2所示装置可电解食盐水制氯气和氢气 |
| C.图3所示装置可验证氨气极易溶于水 |
| D.图4所示装置与操作可除去苯中的苯酚 |
下列有关物质性质和应用都正确的是( )
| A.氢氟酸具有强酸性,可用于雕刻玻璃 |
| B.氨气显碱性,可用P2O5或无水CaCl2干燥 |
| C.MgO、Al2O3熔点高,它们都可用于制作耐火材料 |
| D.铜的活动性比铁弱,可在海轮外壳装铜块减缓海轮腐蚀 |
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.c(H+)/c(OH-)=1×1014的溶液:Fe2+、K+、HSO 、ClO- 、ClO- |
B.0.1 mol·L-1FeCl3溶液:NH 、H+、I-、SCN- 、H+、I-、SCN- |
C.0.1 mol·L-1Na2CO3溶液:K+、Ca2+、HCO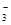 、SO 、SO |
D.使酚酞变红色的溶液:Na+、Ba2+、NO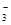 、Cl- 、Cl- |