下列关于热化学反应的描述中正确的是
| A.HCl和NaOH反应的中和热ΔH=-57.3 kJ/mol,则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3) kJ/mol |
| B.CO(g)的燃烧热是283.0 kJ/mol,则2CO2(g) =2CO(g)+O2(g)反应的ΔH=+566.0 kJ/mol |
| C.需要加热才能发生的反应一定是吸热反应 |
| D.Ba(OH)2·8H2O与NH4Cl反应的焓变小于0,所以在常温下能自发进行 |
对于可逆反应:2SO2(g)+O2(g) 2SO3(g) ΔH<0,下列研究目的和示意图相符的是()
2SO3(g) ΔH<0,下列研究目的和示意图相符的是()
| A |
B |
C |
D |
|
| 研究目的 |
压强对反应的影响(p2>p1) |
温度对反应的影响 |
平衡体系增加O2的浓度对反应的影响 |
体积恒定的密闭容器中催化剂对反应的影响 |
| 示 意 图 |
 |
 |
 |
 |
将等物质的量的X、Y气体充入某密闭容器中,在一定条件下,发生如下反应并达到平衡:X(g)+3Y(g) 2Z(g);△H<0。当改变某个条件并维持新条件直至新的平衡时,下表中关于新平衡与原平衡的比较正确的是()
2Z(g);△H<0。当改变某个条件并维持新条件直至新的平衡时,下表中关于新平衡与原平衡的比较正确的是()
| 改变条件 |
新平衡与原平衡比较 |
|
| A |
升高温度 |
X的转化率变小 |
| B |
增大压强 |
X的浓度变小 |
| C |
充入一定量Y |
Y的转化率增大 |
| D |
使用适当催化剂 |
X的体积分数变小 |
以下物质间的每步转化通过一步反应能实现的是()
| A.Al—Al2O3—Al(OH)3—NaAlO2 | B.Fe—FeCl3—Fe(OH)2—Fe(OH)3 |
| C.S—SO3—H2SO4—MgSO4 | D.N2—NO—NO2—HNO3 |
在密闭容器中将CO和水蒸气的混合物加热到800℃时,有下列平衡:CO+H2O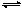 CO2+H2,且K=1。若用2molCO和10mol H2O相互混合并加热到800℃,则CO的转化率为()
CO2+H2,且K=1。若用2molCO和10mol H2O相互混合并加热到800℃,则CO的转化率为()
| A.16.7% | B.50% |
| C.66.7% | D.83.3% |
下列热化学方程式中,△H能正确表示物质的燃烧热的是()
| A.2CO(g) +O2(g) ==2CO2(g) △H=—566.0 kJ/mol |
| B.C(s) +1/2O2(g) ==CO(g) △H=—110.5 kJ/mol |
| C.CH4(g) +2O2(g)="=" CO2(g)+2H2O(l) △H=—890.31 kJ/mol |
| D.2C8H18(l) +25O2(g)==16CO2(g)+18H2O(l) △H=—11036 kJ/mol |