红磷P(s)和Cl2发生反应生成PCl3和PCl5,反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据)
据图回答下列问题
(1)P和Cl2反应生成PCl3的热化学方程式 ;
(2)PCl5分解生成PCl3和Cl2的热化学方程式 ;
上述分解反是一个可逆反应,温度T1时,在密闭容器中加入0.8mol PCl5,反应达到平衡时还剩余0.6mol PCl5,其分解率α1等于 ;若反应温度由T1升高到T2,平衡时PCl5分解率α2,α2 α1(填“大于”,“小于”或“等于”);
(3)工业上制备PCl5通常分两步进行,先将P和Cl2反应生成中间产物PCl3,然后降温,再和Cl2反应生成PCl5。原因是 ;
(4)P和Cl2分两步反应生成1mol PCl5的△H3= ;P和Cl2一步反应生成1mol PCl5的△H4 △H3 (填“大于”、“小于”或“等于”),原因是 。
氢气是一种清洁能。用甲烷制取氢气的两步反应的能量变化如下图所示: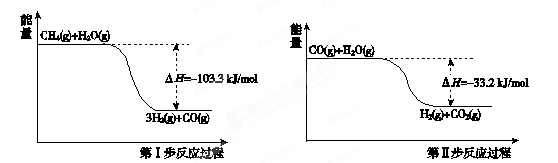
(1)甲烷和水蒸气反应生成二氧化碳和氢气的热化学方程式是 。
(2)第II步为可逆反应。在800℃时,若CO的起始浓度为2.0 mol/L,水蒸气的起始浓度为3.0 mol/L,达到化学平衡状态后,测得CO2的浓度为1.2 mol/L,则此反应的平衡常数为 ,随着温度升高该反应的化学平衡常数的变化趋势是 。
(3)在恒温恒容密闭容器中进行的第II步反应,下列说法中能表示达到平衡状态的是______(填序号)。
a. 四种物质的浓度比恰好等于化学方程式中各物质的化学计量数之比
b. 单位时间内断开amol H-H键的同时断开2a mol O-H键
c. 反应容器中放出的热量不再变化
d. 混合气体的密度不再发生变化
e. 混合气体的压强不再发生变化
(4)某温度下,第II步反应的平衡常数为K=1/9。该温度下在甲、乙、丙三个恒容密闭容器中投入H2O(g)和CO(g),其起始浓度如下表所示。下列判断不正确的是 。
| 起始浓度 |
甲 |
乙 |
丙 |
| c(H2O)/ mol/L |
0.010 |
0.020 |
0.020 |
| c(CO)/ mol/L |
0.010 |
0.010 |
0.020 |
A. 反应开始时,丙中的反应速率最快,甲中的反应速率最慢
B. 平衡时,甲中和丙中H2O的转化率均是25%
C. 平衡时,丙中c(CO2)是甲中的2倍,是0.015mol/L
D. 平衡时,乙中H2O的转化率大于25%
卤化物和卤酸盐在工业生产中有着重要的作用。某小组为探究其中一些盐的性质,查阅资料并进行实验。查阅资料如下:
① BrO3- + 6I- + 6H+ = 3I2+ Br-+ 3H2O
② 2BrO3- + I2= 2IO3- + Br2
③ IO3- + 5I- + 6H+ = 3I2+ 3H2O
④ 2IO3- + 10Br-+ 12H+ = I2+ 5Br2+ 6H2O
实验如下:
| 步骤 |
现象 |
| ⅰ. 向盛有30 mL 0.2 mol·L-1 KI溶液的锥形瓶中依次滴入几滴淀粉溶液和足量稀硫酸,再用滴定管逐滴加入KBrO3溶液 |
随着KBrO3溶液的滴入,溶液由无色变为蓝色并逐渐加深,最终保持不变 |
| ⅱ. 继续向上述溶液中滴入KBrO3溶液 |
溶液的蓝色逐渐褪去 |
请回答:
(1)步骤ⅰ开始时发生的反应如资料①所示,溶液中I-完全被氧化时转移 mol e-,该反应中硫酸表现出的化学性质是 。
(2)上述资料中的反应 (填序号)可表示步骤ⅱ中的反应,通过该反应 (填“能”或“不能”)说明碘的非金属性强于溴,原因是 。
(3)根据资料中的反应①~④并结合所学知识,判断IO3-、BrO3-、I2、Br2的氧化性由强到弱的顺序是 ;KBrO3溶液与KBr溶液在酸性条件下反应的离子方程式是 。
(4)若用y表示锥形瓶中含碘物质的物质的量,用x表示所滴入KBrO3的物质的量,在图中画出上述整个实验过程中y随x的变化曲线(要求:在图中标出终点坐标)。
脱水偶联反应是一种新型的直接烷基化反应,例如: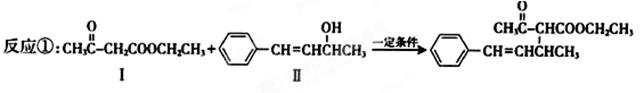
(1)化合物Ⅰ的分子式为 ,1mol该物质完全燃烧最少需要消耗 molO2。
(2)化合物Ⅱ可使 溶液(限写一种)褪色;以化合物Ⅱ为原料可制备高分子化合物,其结构简式是 ;化合物Ⅲ(分子式为C10H11C1)可与NaOH水溶液共热生成化合物Ⅱ,相应的化学方程式为 。
(3)化合物Ⅲ与NaOH乙醇溶液共热生成化合物Ⅳ,Ⅳ的核磁共振氢谱除苯环峰外还有四组峰,峰面积之比为1:1:1:2,Ⅳ的结构简式为 。
(4)由CH3COOCH2CH3可合成化合物Ⅰ。化合物Ⅴ是CH3COOCH2CH3的一种无支链同分异构体,碳链两端呈对称结构,且在Cu催化下与过量O2反应生成能发生银镜反应的化合物Ⅵ。Ⅴ的结构简式为 ,Ⅵ的结构简式为 。
(5)一定条件下,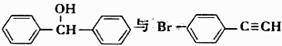 也可以发生类似反应①的反应,有机产物的结构简式为 。
也可以发生类似反应①的反应,有机产物的结构简式为 。
【化学----选修有机化学基础】合成肉桂酸异戊酯G( )的路线如下:
)的路线如下: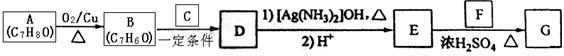
友情提示:
①B和C含有相同的官能团且C在标准状况下的气体密度为1.964g/L;
② 。
。
回答下列问题:
(1)A的结构简式为 ,D中含有的官能团的名称是 ;
(2)下列物质在一定条件下能与F反应的是 (填标号);
A.溴水B.酸性KMnO4溶液
C.乙酸D.新制氢氧化铜的悬浊液
(3)B和C反应生成D的化学方程式为 。
(4)E和F反应生成G的化学方程式为 ,反应类型为 。(各2分)
(5)A的同分异构体中含有苯环的共有 种(不考虑立体异构且包括A),其中与氯化铁不能发生显色反应且核磁共振氢谱有四组峰,峰面积之比为3:2:2:1的为______ (写结构简式)。(各2分)
【化学------选修物质结构与性质】五种短周期元素甲、乙、丙、丁、戊的原子序数依次增大,甲和丙同族,乙离子和丙离子具有相同的电子层结构。甲和乙、丁、戊均能形成共价型化合物。甲和乙形成的化合物在水中呈碱性,单质丁在单质戊中可燃烧产生白色烟雾。回答下列问题:
(1)五种元素中,原子半径最大的是 ,非金属性最强的是 ;(填元素符号)(各1分);
(2)由甲和乙、丁、戊所形成的共价型化合物中,热稳定性最差的是 ;(用化学式表示);
(3)甲和乙形成的化合物的中心原子的杂化类型为 ;甲和乙形成的化合物可与甲和戊形成的化合物反应,其产物中存在的化学键类型为 ;(各2分)
(4)除乙外,上述元素的电负性从大到小依次为 ;(填元素符号);
(5)单质戊与水反应的离子方程式为 ;
(6)一定条件下1.86g单质丁与2.912L单质戊(标准状况)反应,则产物为 ,(用化学式表示)其物质的量之比为 (各2分)。