将一定量的SO2通入Ca(ClO)2溶液中,下列反应的离子方程式一定错误的是
| A.SO2 + H2O + Ca2+ + 2ClO― → CaSO3↓+ 2H+ + 2ClO― |
| B.SO2 + H2O + Ca2+ + 2ClO― → CaSO4↓+ HClO + H+ + Cl― |
| C.2SO2 + 2H2O + Ca2+ + 2ClO― → CaSO4↓+ 4H+ + 2Cl― + SO42― |
| D.SO2 + H2O + Ca2+ + 3ClO― → CaSO4↓+ 2HClO + Cl― |
下列事实不能用勒沙特列原理解释的有( )
①铁在潮湿的空气中容易生锈;
②实验室可用排饱和食盐水的方法收集氯气;
③常温下,将1mL pH=3的醋酸溶液加水稀释至100mL,测得其pH<5;
④钠与氯化钾共融制备钾Na(l)+KCl(l)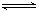 K(g)+NaCl(l);
K(g)+NaCl(l);
⑤二氧化氮与四氧化二氮的平衡体系,加压后颜色加深.
| A.2个 | B.3个 | C.4个 | D.5个 |
FeCl3与KSCN混合时存在下列平衡:Fe3++SCN﹣⇌[Fe( SCN)]2+.已知平衡时,物质的量浓度c[Fe( SCN)]2+与温度T的关系如图,则下列说法正确的是
| A.FeCl3与KSCN反应的热化学反应方程式为:Fe3++SCN﹣⇌ [Fe( SCN)]2+△H>0 |
| B.温度为T1、T2时,反应的平衡常数分别为K1、K2,则K1>K2 |
| C.反应处于D点时,一定有V正>V逆 |
| D.T2温度下,向B点溶液中加入FeCl3固体,平衡状态会从 B点变到A点 |
常温下,下列溶液的pH或微粒的物质的量浓度关系不正确的是 ( )
| A.pH=5.2的CH3COOH与CH3COONa混合溶液中,c(Na+)<c(CH3COO-) |
| B.在滴加酚酞溶液的氨水中,加入NH4Cl溶液恰好无色,则此时溶液的pH﹤7 |
| C.Na2CO3溶液中,c(OH-)-c(H+)= c(HCO3-)+2 c(H2CO3) |
| D.pH=2的一元酸溶液与pH=12的NaOH溶液等体积混合,则溶液的pH一定不大于7 |
常温下,下列离子能使纯水中的OH-离子数目增加的是 ( )
| A.Al3+ | B.CO32- | C.NH4+ | D.Br- |
用下图Ⅰ所示装置通电10分钟后,去掉直流电源,连接成图Ⅱ所示装置,可观察到U形管左端铁电极表面析出白色胶状物质,U形管右端液面上升。下列说法正确的是( )
| A.同温、同压下,装置Ⅰ中石墨电极上方得到的气体比铁电极上方得到的气体多 |
| B.用装置Ⅱ进行实验时铁电极的电极反应为Fe-2e-+2OH-= Fe(OH)2 |
| C.用装置Ⅱ进行实验时石墨电极的电极反应为2H++2e-= H2↑ |
| D.装置Ⅰ通电10分钟后铁电极周围溶液pH降低 |