I、某化学课外活动小组对污染大气的部分非金属氧化物进行探究。请根据题目要求回答下列问题。
(1)写出用硝酸制取NO的离子方程式 。
(2)查资料得知,HCOOH CO+H2O。实验室有如图l所示的装置,制取CO气体可选用的装置为
CO+H2O。实验室有如图l所示的装置,制取CO气体可选用的装置为
(填序号),实验室利用该装置还可制取的常见气体有 (写一种气体的分子式)。
(3)查资料得知,利用催化剂可使汽车尾气中的一氧化碳和氮氧化物大部分发生反应转化为二氧化碳和氮气。该小组在实验室模拟汽车尾气处理,设计了如图2所示装置(部分夹持和装置已略去)。

①实验前,关闭旋塞K,先通氮气排净装置中的空气,其目的是 。
②装置(III)的主要作用是 。
③该套装置中有不完善之处,还应在装置(Ⅳ)后补充 装置。
II、该课外小组设计的从ZnSO4、FeCl3的混合溶液中制取ZnSO4·7H2O过程如下:
a.在混合液中加入6 mol/L NaOH溶液,至pH=8为止。
b.过滤后得到沉淀,用蒸馏水多次洗涤沉淀。
c.向洗涤后的沉淀中加入2 mol/L的硫酸,保持溶液的pH在4~6,加热煮沸,趁热过滤,滤液即为ZnSO4溶液。
d.滤液中加入2 mol/L的硫酸,使其pH=2。
已知部分阳离子以氢氧化物的形式开始沉淀至完全沉淀时溶液的pH见下表,回答下列问题:
| 沉淀物 |
Fe(OH)3 |
Zn(OH)2 |
| pH |
1.5~3.2 |
6.4~8.0 |
(1)步骤b中如何检测沉淀已经洗涤干净 。
(2)步骤d中加入硫酸,使其pH=2的目的是 ;要制得ZnSO4·7H2O的步骤d还缺少的操作是 ,所用的主要硅酸盐仪器是 。
实验室为完成某一实验,需用240mL1.0mol/L的稀盐酸,现用11.8mol/L的浓盐酸配制,填空并请回答下列问题:
(1)配制完成某一实验所需1.0mol/L的盐酸溶液,应量取浓盐酸体积为mL,所用到的玻璃仪器除量筒、烧杯、玻璃棒外还要用到有、等。
(2)配制时,其正确的操作顺序是(用字母表示,每个字母只能用一次) →D。
A.用30mL水洗涤烧杯2—3次,洗涤液均注入容量瓶,振荡
B.用量筒准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.继续往容量瓶内小心加水,直到液面接近刻度1—2cm处
F.改用某仪器加水,使溶液凹液面恰好与刻度相切
(3)若出现如下情况,对所配溶液浓度将有何影响(偏高、偏低或无影响):没有进行A操作 ;C操作时不慎有少量液体溅出容量瓶外;定容时俯视_____________。
(4)10.6gNa2CO3与足量所配制的盐酸反应,生成CO2气体在标准状况下的体积是__________升。
碘溶于碘化钾溶液中形成I3-,并建立如下平衡:I3- I-+ I2。实验室可以通过氧化还原滴定法测定平衡时I3-的浓度。
I-+ I2。实验室可以通过氧化还原滴定法测定平衡时I3-的浓度。
实验原理:
为了测定平衡时的c(I3-),可用过量的碘与碘化钾溶液一起摇动,达平衡后取上层清液用标准的Na2S2O3滴定:2 Na2S2O3 + I2 =" 2NaI" + Na2S4O6。由于溶液中存在I3- I-— + I2的平衡,所以用硫代硫酸钠溶液滴定,最终测得的是I2和I3-—的总浓度,设为c1,c1 = c(I2)+c(I3-);c(I2) 的浓度可用相同温度下,测过量碘与水平衡时溶液中碘的浓度代替,设为c2,则c(I2)= c2,c(I3-)=c1 —c2;
I-— + I2的平衡,所以用硫代硫酸钠溶液滴定,最终测得的是I2和I3-—的总浓度,设为c1,c1 = c(I2)+c(I3-);c(I2) 的浓度可用相同温度下,测过量碘与水平衡时溶液中碘的浓度代替,设为c2,则c(I2)= c2,c(I3-)=c1 —c2;
实验内容:
(1).用一只干燥的100 mL 碘量瓶(测量过程中所用的一种密闭玻璃容器)和一只250 mL碘量瓶,分别标上1、2号,用量筒取80 mL 0.0100 mol.L-1 KI于1号瓶,取200 mL 蒸馏水于2号瓶,并分别加入0.5 g过量的碘。
(2).将两只碘量瓶塞好塞子,振荡30分钟,静置。
(3).分别取上层清液20 mL用浓度为c mol/L标准Na2S2O3溶液进行滴定。1号瓶消耗V1 mL Na2S2O3溶液,2号瓶消耗V2 mL Na2S2O3溶液。
(4).带入数据计算c(I3—)
试回答下列问题
①标准Na2S2O3溶液应装入(填“酸式滴定管”或“碱式滴定管”),原因是。
②碘量瓶在震荡静置时要塞紧塞子,可能的原因是。
③滴定时向待测液中加入的指示剂是,到达滴定终点时的现象为。
④用c 、V1和V2表示c(I3-)为mol·L-1。
⑤若在测定1号瓶时,取上层清液时不小心吸入了少量的I2固体,则测定的c(I3-)
(填“偏大”、“偏小”或“不变”)
(17分)掌握仪器名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置。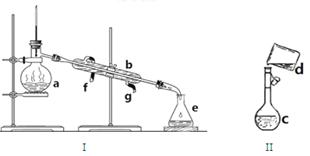
(1)写出下列仪器的名称:a.、b.、c.
(2)仪器a~e中,使用前必须检查是否漏水的有(填序号)
(3)若用装置I分离水和酒精的混合物,还缺少的仪器是,将仪器补充完整后进行实验,温度计水银球的位置在处。冷凝水由口通入,口流出(填f或g)
(4)现需配制0.1mol/LNaOH溶液450mL,装置II是某同学转移溶液的示意图。
①图中的错误是
②除了图中给出的的仪器和托盘天平外,为完成实验还需要的仪器有:
③根据计算得知,所需NaOH的质量为g
④配制时,其正确的操作顺序是(用字母表示,每个字母只能用一次) ________
| A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶 |
| B.准确称一定质量的NaOH固体于烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其充分溶解 |
| C.恢复到室温后将NaOH溶液沿玻璃棒注入500mL的容量瓶中(有少量溶液因操作不慎溅出瓶外) |
| D.将容量瓶盖紧,振荡、摇匀 |
E.改用胶头滴管加水,仰视使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度2~3cm处
⑤按以上操作步骤配得的NaOH溶液的物质的量浓度(填“偏大”、“不变”或“偏小”)
(15分)
I2O5是白色固体,遇水生成碘酸(HIO3)。I2O5可用于检验并定量测定空气中的CO,在常温下发生的反应为 5CO+I2O5=5CO2+I2(空气中其余气体不与I2O5反应)。
实验一:制取I2O5
将碘酸加热至90~110 ºC使其部分脱水,再升温至220~240 ℃并恒温4 h,使反应完全。接着慢慢冷却至室温,密封保存,即得五氧化二碘。
(1)写出碘酸制I2O5的化学方程式: 。
(2)在制得的I2O5固体中含有少量I2杂质,提纯的方法是 (填标号);
A.过滤 B.蒸发结晶 C.蒸馏 D.升华
该提纯方法用到的玻璃仪器为 (填标号)。
A.圆底烧瓶 B.烧杯 C.普通漏斗 D.酒精灯 E.玻璃棒
实验二:检验空气中CO利用下图装置检验空气中是否存在CO。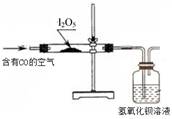
(3)能说明空气中含有CO的现象是 。
(4)倘若要从广口瓶中出现浑浊来判断空气中含有CO,请写出改进的实验方案: 。
实验三:测定空气中CO的含量
(5)将I2O5与CO反应生成的碘单质用硫代硫酸钠滴定(反应为I2+2Na2S2O3=Na2S4O6+2NaI),即可根据消耗硫代硫酸钠的量来计算空气中CO的含量。若某次实验时测得参与反应的空气体积为a mL(标准状况下),滴定过程中,共消耗v mL c mol·L-1 Na2S2O3溶液。则该空气样品中CO的体积分数是 。
(6)该实验方案存在的一个明显缺陷是 。
某学校化学学习小组为探究二氧化氮的性质,按下图所示装置进行实验。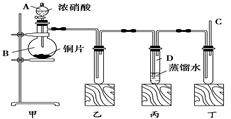
请回答下列问题:
(1)装置甲中盛放浓硝酸的仪器A的名称是________,该装置中发生反应的化学方程式______________。
(2)实验过程中,装置乙、丙中出现的现象分别是_________________________、____________________;
装置丙中的试管内发生反应的离子方程式为:_____________________________________。
(3)为了探究NO的还原性,可以在装置丁的导气管C中通入一种气体,通入的这种气体的名称是______________________________。
(4)取下装置丙中的试管D,在其中滴加FeSO4溶液,溶液变为________色,为了证明铁元素在该反应中的产物,可以再在溶液中滴加KSCN溶液,溶液变为________色。