下列电解质溶液的有关叙述正确的是
| A.常温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4 |
| B.为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH.若pH >7,则H2A是弱酸;若pH<7,则H2A是强酸 |
| C.用0.2000 mol/L NaOH标准溶液滴定HCI与CH3COOH的混合液(混合液中两种酸的浓度均约为0.1 mol/L),至中性时,溶液中的酸未被完全中和 |
| D.相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水②0.1mol/L盐酸③0.1 mol/L氯化镁溶液④0.1 mol/L硝酸银溶液中,Ag+浓度:①>④=②>③ |
高铁酸钾是一种高效绿色水处理剂,其工业制备的反应原理为
2Fe(OH)3 + 3KClO + 4KOH=2K2FeO4 + 3KCl + 5H2O,下列说法正确的是
| A.制备高铁酸钾用ClO−做还原剂 |
| B.制备高铁酸钾时1 mol Fe(OH)3得到3 mol 电子 |
| C.高铁酸钾中铁的化合价为+7 |
| D.用高铁酸钾处理水时,其还原产物能水解产生具有强吸附能力的胶体 |
同位素示踪法可用于反应机理的研究,下列有关反应中同位素示踪表示正确的是
| A.2Na218O2 + 2H2O=4Nal8OH + O2↑ |
| B.2KMnO4 + 5H218O2 + 3H2SO4=K2SO4 + 2MnSO4 + 518O2↑ + 8H2O |
C.NH4Cl + 2H2O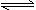 NH3·2H2O + HCl NH3·2H2O + HCl |
| D.K37ClO3 + 6HCl=K37Cl + 3Cl2↑ + 3H2O |
氮化钠和氢化钠与水反应的化学方程式如下:Na3N + 3H2O=3NaOH + NH3,NaH + H2O=NaOH + H2↑。有关Na3N和NaH的叙述正确的是
| A.离子半径:Na+>N3->H+ |
| B.与水反应都是氧化还原反应 |
| C.与盐酸反应都只生成一种盐 |
| D.加热熔化时,都只破坏离子键 |
向红色溶液X中通入气体Y,溶液逐渐褪色,下列对X、Y的推断正确的是
| A.若X为品红溶液,则Y可能为CO2或SO2 |
| B.若X为含酚酞的NaOH溶液,则Y可能是O3 |
| C.若X为含KSCN的FeCl3溶液,则Y一定为HI |
| D.若X为含少量KMnO4的H2SO4溶液,则Y一定为SO2 |
下列离子或分子组中能大量共存,且满足相应要求的是
| 选项 |
离子或分子 |
要求 |
| A |
K+、NO3-、Cl-、HS- |
c(K+) > c(Cl-) |
| B |
Fe3+、MnO4−、SO32-、Cl- |
滴加盐酸立即有气体产生 |
| C |
NH4+、Al3+、SO42-、CH3COOH |
滴加NaOH溶液立即有气体产生 |
| D |
Na+、HCO3-、Ca2+、I- |
通CO2气体有沉淀产生 |