科学家利用太阳能分解水生成的氢气在催化剂作用下 与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池。已知:H2(g)、CO(g)和CH3OH(1)的燃烧热△H分别为-285.8 kJ .
.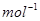 、一283.0 kJ
、一283.0 kJ 和一726.5.kJ
和一726.5.kJ 。请回答下列问题:
。请回答下列问题:
(1)用太阳能分解10mol H2O(1)消耗的能量是________kJ.
(2)甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为:
__________________________________________________________________________.
(3)在容积为2L的密闭容器中,由CO2和H2合成甲醇,在其他条件不变的情况下,
考查温度对反应的影响,实验结果如下图所示(注: 、
、 均大于300℃):
均大于300℃):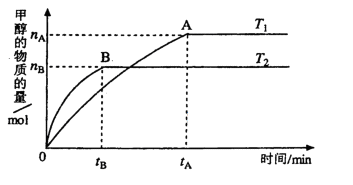
下列说法正确的是_______________(填序号)
①温度为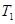 时,从反应开始到反应达到平衡,生成甲醇的平均速率为:
时,从反应开始到反应达到平衡,生成甲醇的平均速率为: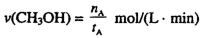
②该反应在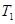 时的平衡常数比
时的平衡常数比 时的小
时的小
③该反应为放热反应
④处于A点的反应体系的温度从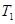 变到
变到 ,达到平衡时
,达到平衡时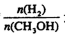 增大
增大
(4)在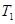 温度时,将1mol CO2和3mol H2充入一密闭恒容容器中,充分反应达到平衡后,若CO2的转化率为a,则此时容器内的压强与起始压强之比为___________。
温度时,将1mol CO2和3mol H2充入一密闭恒容容器中,充分反应达到平衡后,若CO2的转化率为a,则此时容器内的压强与起始压强之比为___________。
(5)在直接以甲醇为燃料的燃料电池中,电解质溶液为酸性,负极的反应式为___________________;正极的反应式为_____________________________________.理想状态下,该燃料电池消耗lmol甲醇所能产生的最大电能为701.8kJ,则该燃料电池的理论效率为_______________(燃料电池的理论效率是指电池所产生的最大电能与燃料电池反应所能释放的全部能量之比)。
阿司匹林(乙酰水杨酸)已应用百年,成为医药史上三大经典药物之一,至今它仍是世界上应用最广泛的解热、镇痛和抗炎药,也是作为比较和评价其他药物的标准制剂。乙酰水杨酸受热易分解,分解温度为128~135℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成该物质,设计的合成路线为:
一、制备K
二、提纯
方案1
方案2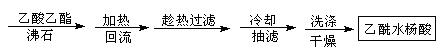
主要试剂和产品的物理常数
| 名称 |
相对分子质量 |
熔点或沸点(0C) |
水 |
醇 |
醚 |
| 水杨酸 |
138 |
158(熔点) |
微溶 |
易溶 |
易溶 |
| 醋酸酐 |
102 |
139.4(沸点) |
反应 |
可溶 |
易溶 |
| 乙酰水杨酸 |
180 |
135(熔点) |
微溶 |
可溶 |
微溶 |
请根据以上信息回答下列问题:
(1)①合成阿斯匹林时,还会生成一些副产品,其中有一种是高分子,为了分离此物质,方案1中加入A物质为▲溶液。
②本方案抽滤后进行洗涤,其具体操作是▲。
(2)方案2为改进的提纯方法,称为重结晶提纯法。
①该方案中步骤1除了选用乙酸乙酯外,还可选择下列哪些
试剂▲。
A. 乙醇 B. 蒸馏水 C. 乙醚
②步骤2回流的装置如图所示,写出仪器a的名称▲,使用温度计的目的是▲,冷凝水的流向为▲。
③方案2所得产品的有机杂质要比方案1少的原因是▲。
(3)该学习小组在实验中原料用量:2.0g水杨酸、5.0ml醋酸酐(ρ=1.08g·cm-3),
最终称量产品m="2.2g" ,则乙酰水杨酸的产率为▲。
氨有着广泛的用途,如可用于化肥、硝酸、合成纤维等工业生产。氨的水溶液中存在电离平衡,常用电离常数Kb和电离度α来定量表示其电离程度。Kb和α常用的测定方法:在一定温度时用酸度计测定一系列已知浓度氨水的pH,可得各浓度氨水对应的c(OH-),然后通过换算求得各对应的α值和Kb值。下面是某中学化学兴趣小组在25℃时测定一系列浓度氨水的pH所对应的c(OH-):
【仪器与试剂】酸度计、50 mL碱式滴定管、100mL烧杯、 0.10 mol·L-1氨水
【实验数据】(不必填表格)
| 烧杯号 |
V氨水 (mL) |
V水(mL) |
c (NH3·H2O)(mol·L-1) |
c(OH-) |
Kb |
α |
| 1 |
50.00 |
0.00 |
1.34×10-3 |
|||
| 2 |
25.00 |
25.00 |
9.48×10-4 |
|||
| 3 |
5.00 |
45.00 |
4.24×10-4 |
请根据以上信息回答下述问题:
(1)25℃时,氨水的电离常数:Kb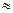 ▲,通过计算所得的数据和简洁的文字说明电离常数、电离度与弱电解质的初始浓度的关系▲。
▲,通过计算所得的数据和简洁的文字说明电离常数、电离度与弱电解质的初始浓度的关系▲。
(2)用0.10mol·L—1盐酸分别滴定20.00mL0.10mol·L—1的NaOH溶液和20.00mL0.10mol·L—1
氨水所得的滴定曲线如下: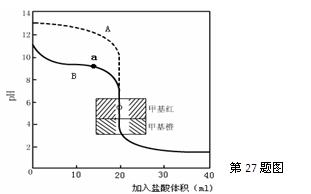
请指出盐酸滴定氨水的曲线为▲(填A或B),请写出曲线a点所对应的溶液中各离子浓度由大到小的排列顺序▲。
(3)液氨作为一种潜在的清洁汽车燃料已越来越被研究人员重视。它在安全性、价格等方面较化石燃料和氢燃料有着较大的优势。氨在燃烧试验机中相关的反应有:
4NH3(g)+3O2(g)= 2N2(g)+6H2O(l)△H1①
4NH3(g)+5O2(g)= 4NO(g)+6H2O(l)△H2②
4NH3(g)+6NO(g)= 5N2(g)+6H2O(l)△H3③
请写出上述三个反应中△H1、△H2、△H3三者之间关系的表达式,△H1=▲。
(4)Allis-Chalmers制造公司发现可以用氨作为燃料电池的燃料。其总反应式为4NH3+3O2= 2N2+6H2O,正极上的电极反应式为O2+2H2O+4e—=4OH—,则负极上的电极反应式为▲。
下表由元素周期表的前三周期去掉副族上方的空白区域后组合而成,表中虚线处为ⅡA、ⅢA族的连接处。请用相应的化学用语回答下列问题:
| a |
|||||||
| b |
c |
d |
e |
f |
|||
| g |
h |
(1)上述标出的8种元素中金属性最强的是,非金属性最强的是。(填元素符号)
(2)e元素名称为,位于第周期族。
(3)h的单质能与g元素的最高价氧化物对应的水化物的溶液反应,请写出该反应的离子方程式。
(4)g 和e形成的化合物g2e2是化合物(填“离子”或“共价”),其电子式为__。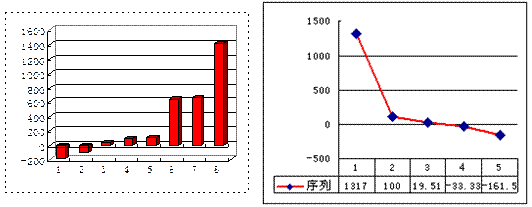
(5)上左图是表示第三周期8种元素单质的熔点(℃)柱形图,已知柱形“1”代表Ar,则其中柱形“8”代表Si,则其中柱形“2”代表。(填化学式)
(6)b、c、d、e、f的氢化物的沸点(℃)直角坐标图(上右图),序列“5”的氢化物的名称是,序列“2”的氢化物的结构式为。
氢气是未来最理想的能源,科学家最近研制出利用太阳能产生激光,并在二氧化钛(TiO2)表面作用使海水分解得到氢气的新技术2H2O 2H2↑+O2↑ 。制得的氢气可用于燃料电池。试完成下列问题:
2H2↑+O2↑ 。制得的氢气可用于燃料电池。试完成下列问题:
太阳光分解海水时,实现了从_______能转化为_______能,二氧化钛作________。生成的氢气,用于燃料电池时,实现________能转化为________能。燃料电池中通入氢气的是极(填“正”或“负”),分解海水的反应属于________反应(填“放热”或“吸热”)。
向体积为2L的容器中加入1mol N2和6mol H2进行可逆反应:N2+3H2 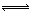 2NH3,
2NH3, 后测得N2的物质的量为0.6mol,则:
后测得N2的物质的量为0.6mol,则:
(1)2min内,N2的物质的量减少了0.4mol,H2的物质的量减少了________mol,NH3的物质量增加了________mol。
(2)若用N2的浓度变化来表示该反应的反应速率为mol/(L·min)。
(3)若用H2的浓度变化来表示该反应的反应速率为mol/(L·min)。
(4)若用NH3的浓度变化来表示该反应的反应速率为mol/(L·min)。
(5)通过上述计算,你有什么发现?____________________________。