某储能电池的原理如图所示,溶液中c(H+)=2.0mol·L-1,阴离子为SO42-,a、b均为惰性电极,充电过程中左槽溶液颜色由蓝色变为黄色。下列叙述正确的是
| A.当右槽溶液颜色由绿色变为紫色时,电池中能量转化形式为化学能转化为电能 |
| B.充电过程中,a极的反应式为VO2+—e—+H2O=VO2++2H+ |
| C.储能电池a、b两极间的电解质溶液中通过电子的定向移动形成闭合回路 |
| D.放电时,当转移的电子数为6.02×1023时,从右槽迁移进入左槽的H+的物质的量为2mol |
氨水有下列平衡NH3·H2O NH4++OH-,当其他条件不变时,改变下列条件,平衡向左移,且c(NH4+)增大的是
NH4++OH-,当其他条件不变时,改变下列条件,平衡向左移,且c(NH4+)增大的是
| A.加NaOH | B.加盐酸 | C.加NH4Cl | D.加同浓度氨水 |
某次酸雨的分析数据如下:c(NH4+)=2.0×10-5 mol·L-1,c(Cl-)=6.0×10-5 mol·L-1,c(Na+)=1.9×10-5 mol·L-1,c(NO3—)=2.3×10-5 mol·L-1,c(SO42—)=2.8×10-5 mol·L-1,则此次酸雨的pH大约为
| A.3 | B.4 | C.5 | D.6 |
体积相同的甲、乙两个容器中,分别都充有等物质的量的SO2和O2,在相同温度下发生反应:2SO2+O2 2SO3,并达到平衡,在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率
2SO3,并达到平衡,在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率
| A.等于p% | B.大于p% | C.小于 p% | D.无法判断 |
高温下,某反应达到平衡,平衡常数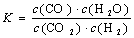 。恒容时,温度升高,H2浓度减小。下列说法正确的是
。恒容时,温度升高,H2浓度减小。下列说法正确的是
A.该反应的化学方程式为CO+H2O CO2+H2 CO2+H2 |
| B.恒温恒容下,增大压强,H2浓度一定减小 |
| C.升高温度,正反应速率增大,逆反应速率减小 |
| D.该反应的焓变为正值 |
下列物质加入水中,因水解而使溶液呈酸性的是
| A.CuCl2 | B.NaHSO4 | C.NaHCO3 | D.SO2 |