已知:还原性HSO3¯>I¯,氧化性IO3¯> I2。在含3 mol NaHSO3的溶液中逐滴加入KIO3溶液。加入KIO3和析出I2的物质的量的关系曲线如右图所示。下列不正确的是( )

| A.0~b :3HSO3-+ IO3-= 3SO42-+ I-+ 3H+ |
| B.a点时消耗NaHSO3的物质的量为1.2 mol |
| C.b~c间I2是还原产物 |
| D.当溶液中I¯与I2的物质的量之比为5∶2时,加入的KIO3为1.8mol |
对下列反应①KHCO3溶液与石灰水反应、②Na2SO3溶液与稀盐酸反应、③Si与烧碱溶液反应、
④Fe与稀硝酸反应。改变反应物用量,不能用同一个离子方程式表示的是( )
| A.①②③ | B.①②④ | C.①③④ | D.②③④ |
下列溶液中的各组离子,通入过量SO2气体后仍能大量存在的是
| A.Ba2+、Ca2+、Cl- | B.OH-、CO32-、Na+ | C.Ca2+、ClO-、Cl- | D.H+、Fe3+、SO42— |
下列有关说法正确的是
| A.25℃101kPa时,CH4(g)+2O2(g)=CO2(g) +2H2O(g)△H=-Q kJ/mol,则甲烷的燃烧热为Q kJ/mol |
| B.CaCO3(s)=CaO(s)+CO2(g) 室温下不能自发进行,说明该反应的 ΔH<0 |
C.反应N2(g)+3H2(g) 2NH3(g)ΔH<0达到平衡后,升高温度,反应速率v(H2)和H2的平衡转化率均增大 2NH3(g)ΔH<0达到平衡后,升高温度,反应速率v(H2)和H2的平衡转化率均增大 |
| D.已知氯气、溴蒸气分别跟氢气反应的热化学方程式如下(Q1、Q2的值均大于零): |
H2(g) +Cl2(g)=2HCl(g)△H1=—Q1 kJ/mol
H2(g) +Br2(g)=2HBr(g)△H2=—Q2 kJ/mol则△H1<△H2
关于反应3A (g)+ B (g) 2 C (g) 发生过程中的能量变化如图,下列说法中不正确的是
2 C (g) 发生过程中的能量变化如图,下列说法中不正确的是
| A.该反应为放热反应 |
| B.反应体系中加入催化剂, E1、E2减小,△H不变 |
| C.增大反应体系压强,化学平衡正向移动,气体B的浓度减少 |
| D.降低反应体系温度,反应速率减慢,A的转化率增大 |
下图是可逆反应A+2B  2C+3D的化学反应速率与化学平衡随外界条件改变(降温和加压)而变化的情况,由此可推断()
2C+3D的化学反应速率与化学平衡随外界条件改变(降温和加压)而变化的情况,由此可推断()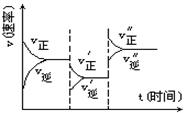
A.正反应是吸热反应 B.若A、B是气体,则D是液体或固体
C.逆反应是放热反应. D.A、B、C、D均为气体