用4种溶液进行实验,下表中“试剂和操作”与“现象”对应关系正确的是
| 选项 |
试剂和操作 |
现象 |
| A |
向AlCl3溶液中滴入过量的氨水 |
溶液先有白色沉淀,后来沉淀消失 |
| B |
向新生成的AgC1浊液中滴入KI溶液,振荡 |
白色沉淀逐渐转化为黄色沉淀 |
| C |
向Ca(C1O)2溶液中先通入CO2,再加入少量品红溶液 |
溶液先变浑浊,通入CO2后品红的红色不褪去 |
| D |
向BaC12溶液中先通入SO2,再通入过量NO2 |
先生成沉淀,后来沉淀消失 |
下列实验操作能够达到实验目的的是
| A.从溴水中提纯单质溴的方法是:先用CCl4萃取,分液后再蒸馏 |
| B.取少量溶液X,向其中加入适量新制氯水,再加几滴KSCN溶液,溶液变红,说明X溶液中一定含有Fe2+ |
| C.用盛NaOH溶液的洗气瓶除去CO2中混有的HCl气体 |
| D.在实验室里,用澄清的石灰水和氯化铵溶液混合制取氨气 |
下列离子反应,表达正确的是
| A.氯气通入水中:Cl2+H2O=2H++Cl-+ClO- |
B.过量CO2通入硅酸钠溶液:CO2+H2O+ = = +H2SiO3↓ +H2SiO3↓ |
| C.向酸性高锰酸钾溶液中加入少量过氧化氢溶液: 2  +H2O2+6H+ +H2O2+6H+ 2Mn2++3O2↑+4H2O 2Mn2++3O2↑+4H2O |
| D.向硫酸氢钾溶液中加入Ba(OH)2溶液至pH=7: |
2H++ +Ba2++2OH-=BaSO4↓+2H2O
+Ba2++2OH-=BaSO4↓+2H2O
美日科学家因在研究“钯催化交叉偶联反应”所作出的杰出贡献,获得了2010年诺贝尔化学奖。钯的化合物PdCl2通过化学反应可用来检测有毒气体CO,该反应的反应物与生成物有:CO、Pd、H2O、HCl、PdCl2和一种未知物X。下列说法不正确的是
| A.反应中CO作还原剂 |
| B.未知物质X为CO2 |
| C.反应中转移的电子为1mol时,生成2mol物质X |
| D.题述反应条件下还原性:CO>Pd |
将足量SO2通入下列各溶液中,所含离子还能大量共存的是
A.K+、OH-、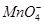 、 、 |
B.Na+、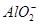 、 、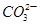 、I- 、I- |
C.H+、 、Ba2+、Cl- 、Ba2+、Cl- |
D.Al3+、Mg2+、Fe3+、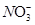 |
下列有关物质性质的说法正确的是
| A.25℃时,NaHCO3在水中的溶解度比Na2CO3的大 |
| B.常温下,铁与干燥的氯气不反应 |
| C.加热蒸干FeCl2溶液,灼烧后得到FeO |
| D.漂白粉使某些染料褪色,不属于化学变化 |