2013年初,雾霾天气多次肆虐天津、北京等地区。其中,燃煤和汽车尾气是造成空气污染的原因之一。
(1)汽车尾气净化的主要原理为:2NO(g) + 2CO(g) 2CO2(g)+ N2(g)。△H<0
2CO2(g)+ N2(g)。△H<0
①该反应平衡常数表达式
②若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是 (填代号)。
(2)直接排放煤燃烧产生的烟气会引起严重的环境问题。
煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOX可以消除氮氧化物的污染。
已知:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867 kJ/mol
2NO2(g) N2O4(g) △H=-56.9 kJ/mol
N2O4(g) △H=-56.9 kJ/mol
H2O(g) = H2O(l) ΔH = -44.0 kJ/mol
写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式: 。
(3)甲烷燃料电池可以提升能量利用率。下图是利用甲烷燃料电池电解100mL1mol/L食盐水,电解一段时间后,收集到标准状况下的氢气2.24L(设电解后溶液体积不变).
①甲烷燃料电池的负极反应式: 。
②电解后溶液的pH= (忽略氯气与氢氧化钠溶液反应)
③阳极产生气体的体积在标准状况下是 L
由黄铜矿(主要成分是CuFeS2)炼制精铜的工艺流程示意图如下:
(1)在反射炉中,把铜精矿砂和石英砂混合加热到1000℃左右,黄铜矿与空气反应生成Cu和Fe的低价硫化物,两种低价硫化物的化学式分别为________、_______。在反应过程中还有一部分Fe的硫化物转化为低价氧化物,其化学反应方程式为____________。
(2)冰铜(Cu2S和FeS互相熔合而成)含Cu量较低。转炉中,将冰铜加熔剂(石英砂)在1200℃左右吹入空气进行吹炼。冰铜中的Cu2S被氧化成Cu2O,,每有1mol氧气参加反应,生成氧化产物的物质的量为_________。生成的Cu2O与Cu2S反应,可制得含Cu量较高的粗铜。
(3)粗铜的电解精炼如图所示。在粗铜的电解过程中,c为粗铜板, 则a端应连接电源的_____极(填“正”或“负”),若粗铜中含有Au、Ag、Fe杂质,则电解过程中c电极上发生反应的方程式有__________。
(4)可以应用酸性高锰酸钾溶液滴定法测定反应后电解液中铁元素的含量。滴定时不能用碱式滴定管盛放酸性高锰酸钾溶液的原因是____________,发生反应的离子方程式为_____________,滴定时,锥形瓶中的溶液会接触空气,测得铁元素的含量会____(填“偏高”或“偏低”)。
碳和硅属于同主族元素,在生活生产中有着广泛的用途。
(1)甲烷可用作燃料电池,将两个石墨电极插入KOH溶液中,向两极分别通入CH4和O2,构成甲烷燃料电池,通入CH4的一极,其电极反应式是;
CH4催化还原NOX可以消除氮氧化物的污染,有望解决汽车尾气污染问题,反应如下:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ·mol-1
则NO2被甲烷还原为N2的热化学方程式为_____________________________________
(2)已知H2CO3 HCO3-+ H+ Ka1(H2CO3)=4.45×10-7
HCO3-+ H+ Ka1(H2CO3)=4.45×10-7
HCO3- CO32-+H+ Ka2(HCO3-)=5.61×10-11
CO32-+H+ Ka2(HCO3-)=5.61×10-11
HA H++A- Ka(HA)=2.95×10-8
H++A- Ka(HA)=2.95×10-8
请依据以上电离平衡常数,写出少量CO2通入到NaA溶液中的离子方程式
___________________________。
(3) 在T温度时,将1.0molCO2和3.0molH2充入2L密闭恒容器中,可发生反应的方程式为CO2 (g) + 3H2(g)  CH3OH(g) + 2H2O(g) 。充分反应达到平衡后,若容器内的压强与起始压强之比为a :1,则CO2转化率为______,当a=0.875时,该条件下此反应的平衡常数为_______________(用分数表示)。
CH3OH(g) + 2H2O(g) 。充分反应达到平衡后,若容器内的压强与起始压强之比为a :1,则CO2转化率为______,当a=0.875时,该条件下此反应的平衡常数为_______________(用分数表示)。
(4)氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英(SiO2)与焦炭在高温的氮气流中反应生成,已知该反应的平衡常数表达式K=[c(CO)]6/[c(N2)]2,若已知CO生成速率为v(CO)=6mol·L-1·min-1,则N2消耗速率为v(N2)=;该反应的化学方程式为________________________________________。
在有机化工生产中,下图是合成某种聚酯纤维H的流程图。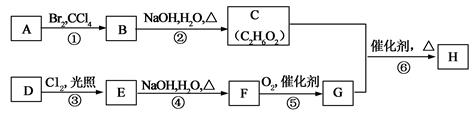
已知:A、D为烃,质谱图表明G的相对分子质量为166,其中含碳57.8%,含氢3.6%,其余为氧;G能与NaHCO3溶液反应且含有苯环;核磁共振氢谱表明E、G分子中均有两种类型的氢原子,且E分子中两种类型的氢原子的个数比为1∶1。
(1)①、③ 的反应类型依次为、;
(2)B的名称为:;E的结构简式为:;
(3)写出下列化学方程式:
②;
⑥;
(4)F有多种同分异构体,写出同时符合下列条件的所有同分异构体的结构简式。
a.含有苯环且苯环上只有2个取代基
b.能与NaOH溶液反应
c.在Cu催化下与O2反应的产物能发生银镜反应
已知元素A、B、C、D、E、F均属前四周期,且原子序数依次增大, A的p能级电子数是s能级电子数的一半,C的基态原子2p轨道有2个未成对电子;C与D形成的化合物中C显正化合价;E的M层电子数是N层电子数的4倍,F的内部各能级层均排满,且最外层电子数为1。请回答下列问题:
(1)C原子基态时的电子排布式为。
(2)B、C两种元素第一电离能为:﹥(用元素符号表示)。
试解释其原因: 。
(3)任写一种与AB- 离子互为等电子体的微粒。
(4)B与C形成的四原子阴离子的立体构型为,其中B原子的杂化类型是。
(5)D和E形成的化合物的晶胞结构如图,其化学式为,E的配位数是;已知晶体的密度为 ρ g·cm-3,阿伏加德罗常数为NA,则晶胞边长a=cm.(用含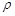 、NA的计算式表示)
、NA的计算式表示)
某实验小组用燃烧分析法测定某有机物中碳和氢等元素的含量,随后又对其进行了性质探究。将已称量的样品置于氧气流中,用氧化铜作催化剂,在高温条件下样品全部被氧化为水和二氧化碳,然后分别测定生成的水和二氧化碳。实验可能用到的装置如下图所示,其中A、D装置可以重复使用。
请回答下列问题:
(1)请按气体流向连接实验装置B→→C→A→D→(用装置编号填写)。
(2)B装置中制O2时所用的药品是。实验中,开始对C装置加热之前,要通一段时间的氧气,目的是;停止加热后,也要再通一段时间的氧气,目的是 .。
(3)已知取2.3g的样品X进行上述实验,经测定A装置增重2.7g,D装置增重4.4g。试推算出X物质的实验式。
(4)该小组同学进一步实验测得:2.3g的 X与过量金属钠反应可放出560mLH2(已换算成标准状况下),且已知X分子只含一个官能团。查阅资料后,学生们又进行了性质探究实验:实验一:X在一定条件下可催化氧化最终生成有机物Y;实验二:X与Y在浓硫酸加热条件下生成有机物Z。则:①写出实验二中反应的化学方程式。
② 除去Z中混有的Y所需的试剂和主要仪器是、。
(5)若已知室温下2.3g液态X在氧气中完全燃烧生成二氧化碳气体和液态水时可放出68.35kJ的热量,写出X在氧气中燃烧的热化学方程式。