高铁酸钾是一种高效绿色水处理剂,其工业制备的反应原理为
2Fe(OH)3 + 3KClO + 4KOH=2K2FeO4 + 3KCl + 5H2O,下列说法正确的是
| A.制备高铁酸钾用ClO−做还原剂 |
| B.制备高铁酸钾时1 mol Fe(OH)3得到3 mol 电子 |
| C.高铁酸钾中铁的化合价为+7 |
| D.用高铁酸钾处理水时,其还原产物能水解产生具有强吸附能力的胶体 |
已知气体的摩尔质量越小,扩散速度越快.下图所示为气体扩散速度的试验,两种气体扩散相遇时形成白色烟环.下列关于物质甲、乙的判断正确的是
| A.甲是浓氨水,乙是浓硫酸 | B.甲是浓盐酸,乙是浓氨水 |
| C.甲是浓氨水,乙是浓盐酸 | D.甲是浓硝酸,乙是浓氨水 |
由锌、铁、铝、镁四种金属中的两种组成的混和物10克,与足量的盐酸反应产生的氢气在标准状况下为11.2升,则混和物中一定含有的金属是
| A.锌 | B.铁 | C.铝 | D.镁 |
下列说法不正确的是
| A.硫单质与金属铁反应生成FeS,体现了硫单质的氧化性 |
| B.H2S既具有还原性,又具有氧化性 |
| C.SO2能使酸性KMnO4溶液、氯水褪色,说明SO2具有漂白性 |
| D.SO2在一定条件下可转化为SO3 |
灼烧绿矾的反应方程式如下: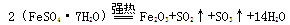
将生成的气体通入BaCl2溶液中,下列叙述中正确的是
| A.有BaSO4生成 | B.有BaSO3生成 |
| C.同时有BaSO4和BaSO3生成 | D.有SO3逸出 |
制取Fe(OH)2并使之能久存,可采取的操作有:①加入一些植物油;②溶解FeSO4配成溶液;③把蒸馏水加热煮沸,并密封冷却;④加入少量铁屑;⑤向FeSO4溶液中滴加足量氨水;⑥把盛有氨水的胶头滴管伸入FeSO4溶液中后再挤出氨水。进行操作的正确顺序是
| A.③②⑤④ | B.③②④①⑥ | C.③②④⑥ | D.②④①⑥ |