工业上冶炼金属钼的化学原理为:
①2MoS2+7O22MoO3+4SO2;
②MoO3+2NH3·H2O===(NH4)2MoO4+H2O;
③(NH4)2MoO4+2HCl===H2MoO4↓+2NH4Cl;
④H2MoO4MoO3+H2O;
⑤用还原剂将MoO3还原成金属钼。
则下列说法正确的是
| A.上述①、③、⑤属于氧化还原反应,②、④属于非氧化还原反应 |
| B.MoO3是金属氧化物,也是碱性氧化物 |
| C.H2MoO4是一种强酸 |
| D.利用H2、CO和Al分别还原等量的MoO3,所消耗还原剂的物质的量之比为3∶3∶2 |
常温下,下列各组离子在指定溶液中能大量共存的是
| A.通入足量CO2后的溶液中:Na+、SiO32-、CH3COO-、SO32- |
| B.饱和氯水中:Cl-、NO3-、Na+、SO32- |
| C.c(H+)=1×10-1 mol•L-1的溶液中:Cu2+、Al3+、SO42-、NO3- |
| D.0.1 mol·L-1 CH3COONa溶液:H+、Al3+、Cl-、NO3- |
对于反应COCl2(g) CO(g)+Cl2(g)。改变下列条件:①升温 ②恒容下通入惰性气体③增加COCl2浓度 ④减压 ⑤加催化剂 ⑥恒压下通入惰性气体,能加快反应速率的是
CO(g)+Cl2(g)。改变下列条件:①升温 ②恒容下通入惰性气体③增加COCl2浓度 ④减压 ⑤加催化剂 ⑥恒压下通入惰性气体,能加快反应速率的是
| A.①②⑤ | B.①③⑤ | C.②④⑥ | D.③⑤⑥ |
甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下转
化关系: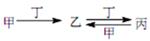 。下列有关物质的推断不正确的是
。下列有关物质的推断不正确的是
| A.若甲为焦炭,则丁可能是 O2 |
| B.若甲为 SO2,则丁可能是氨水 |
| C.若甲为 Fe,则丁可能是盐酸 |
| D.若甲为 NaOH 溶液,则丁可能是 CO2 |
下列做法不利于金属防护的是
| A.菜刀切菜后不洗净就放回刀架 | B.将钢铁制成不锈钢 |
| C.在铁塔的表面喷油漆 | D.埋在地下的钢管与锌块连接 |
下列关于离子的检验方法一定正确的是
| A.向某溶液中滴加BaCl2溶液,有白色沉淀生成,再滴加足量稀HNO3,沉淀不溶解,说明原溶液中一定含有Ag+ |
| B.向某溶液中滴加浓NaOH溶液,加热,产生的气体使湿润的红色石蕊试纸变蓝色,说明原溶液中含NH4+ |
| C.向某溶液中滴加足量稀盐酸,产生使澄清石灰水变浑浊的气体,说明原溶液中一定含CO32- |
| D.用铂丝蘸取某溶液在无色火焰上灼烧,直接观察火焰颜色未见紫色,说明原溶液中不含K+ |