25℃时,向浓度均为0.1mol.L-1的Fe(NO3)3和Al(NO3)3混合溶液中,逐滴加入NaOH溶液,表示生成Al(OH)3的物质的量与加入的NaOH溶液的体积的关系如下图所示(已知当离子浓度小于1×10-5mol.L-1时为沉淀完全)。则下列说法与判断合理的是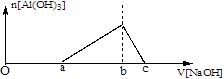
| A.25℃时,Fe(OH)3的溶解度大于Al(OH)3的溶解度 |
| B.25℃时,Fe(OH)3的溶度积大于Al(OH)3的溶度积 |
| C.当生成的Al(OH)3恰好完全溶解时,溶液中的溶质只有NaAlO2 |
| D.图中2a=b=6(c-b) |
有X、Y、Z、W、M五种短周期元素,其中X、Y、Z、W同周期,Z、M同主族;X+与M2-具有相同的电子层结构;离子半径:Z2->W-;Y的单质晶体熔点高、硬度大,是一种重要的半导体材料。下列说法中,正确的是
| A.X、M两种元素只能形成X2M型化合物 |
| B.由于W、Z、M元素的氢气化物相对分子质量依次减小,所以其沸点依次降低 |
| C.元素Y、Z、W的单质晶体属于同种类型的晶体 |
| D.元素W和M的某些单质可作为水处理中的消毒剂 |
化学与生产、生活、社会密切相关。下列说法中不正确的是
| A.绿色化学的核心是从源头上消除工业生产对环境的污染。 |
| B.“硫黄姜”又黄又亮,可能是在用硫黄熏制的过程中产生的SO2所致。 |
| C.铁在潮湿的空气中放置,易发生化学腐蚀而生锈。 |
| D.华商科学家高琨在光纤传输信息领域中取得突破性成就,光纤的主要成分是高纯度的二氧化硅。 |
饱和氯水中存在平衡:①C12+H2O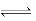 H++Cl—+HClO,②HClO
H++Cl—+HClO,②HClO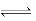 H++ClO—,取饱和氯水分别进行下列实验,相应结论错误的是
H++ClO—,取饱和氯水分别进行下列实验,相应结论错误的是
| A.逐滴加入氨水中,所得溶液中c(H+)逐渐增大 |
| B.继续通入过量C12,①、②均向右移动,溶液pH减小 |
| C.加入CaCO3悬浊液中,CaCO3的溶解平衡向右移动 |
| D.加入一定量NaOH溶液中,所得溶液中离子浓度的关系可能为c(Cl-)+ c(ClO-)= c(Na+) |
下列叙述或解释事实的方程式错误的是
| A.pH=1的NaHSO4溶液中:c(H+)=c(SO42-)+c(OH—) |
B.0.1 mol·L-1 CH3COOH溶液的pH>1:CH3COOH CH3COO—+H+ CH3COO—+H+ |
| C.用NaHCO3溶液做导电实验,灯泡发光:NaHCO3 =Na++H++CO32-。 |
D.盛满NO2的烧瓶浸泡在冷水中,颜色变浅:NO2 (g,红棕色) N2O4(g,无色)△H<0 N2O4(g,无色)△H<0 |
下列关于实验的描述错误的是
| A.将硫酸铜溶液加热蒸发、浓缩、冷却结晶,可以制备硫酸铜晶体 |
| B.测定等浓度NaClO溶液和Na2SO4溶液的pH,比较Cl、S元素的非金属性强弱 |
| C.萃取法除去NaBr溶液中的少量NaI,需要用烧杯、玻璃棒、胶头滴管、分液漏斗 |
| D.检验Na2SO3固体是否被部分氧化:取少量固体溶于水,滴加过量稀盐酸,观察是否产生气泡,再滴加BaCl2溶液,观察是否产生白色沉淀 |