有关钴和铁化合物的性质见下表:
| 化学式 |
溶度积(室温时)Ksp |
沉淀完全时的pH |
氯化钴晶体的性质 |
| Co(OH) 2 |
5.9×10-15 |
9.4 |
CoCl2·6H2O呈红色,常温下稳定。110ºC~120ºC时脱水变成蓝色无水氯化钴 |
| Fe(OH) 2 |
1.6×10-14 |
9.6 |
|
| Fe(OH) 3 |
1.0×10-35 |
x |
用含钴废料(含少量铁)可制备氯化钴:Co+2HCl=CoCl2+H2↑工艺流程如下:
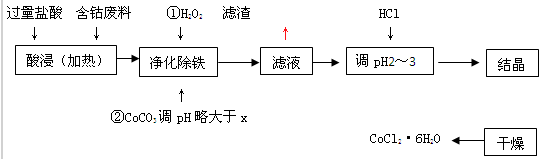
试回答:
(1)“净化除铁”中,写出加入CoCO3(难溶)调pH时反应的离子方程式
(2)滤液中(Fe3+)≤1.0×10-5mol/L时,可视为Fe3+沉淀完全。试计算室温下,Fe(OH) 3沉淀完全时,则x= 。
(3)②步中用CoCO3调pH略大于x的原因是 。
(4)滤液中所含溶质有 , 。
(5)为了防止CoCl2·6H2O脱水,“干燥”时宜采用的方法或操作是 , 。
(1)某温度下,纯水中的c(H+)=2.0×10—7mol/L,此时溶液的c(OH—)=mol/L;若温度不变,滴入稀盐酸使c(H+)=5.0×10—4mol/L,则溶液中c(OH—)=mol/L,由水电离产生的c(H+)=mol/L,此时温度25℃(填“高于”、“低于”或“等于”)。
(2)室温时,将pH=5的H2SO4稀释10倍,则c(H+)∶c(SO42—)=,将稀释后的溶液再稀释1000倍,则c(H+)∶ c(SO42—)=。
(3)有稀硫酸和稀盐酸的混合溶液20ml,向此溶液中滴加0.025mol/LBa(OH)2溶液时,生成沉淀的质量和溶液pH的变化情况如图所示,求: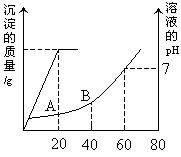
⑴原混合溶液中硫酸和盐酸的物质的量浓度?
⑵滴到A、B两点时溶液的pH 各是多少?
一定温度下,有a、盐酸;b、硫酸;c、醋酸三种酸的稀溶液。(用a、b、c、<、=、>号填写)
①当其物质的量浓度相同时,c(H+)由大到小的顺序是___________________,
②同体积同物质的量浓度的三种酸,中和NaOH能力的顺序是_________________,
③当其c(H+)相同时,物质的量浓度由大到小的顺序为_____________________,
④当c(H+)相同、体积相同时,分别加入足量锌,相同状况产生的气体体积由大到小的顺序为_____________________。
⑤当pH相同、体积相同时,同时加入锌,若产生相同体积的氢气(相同状况)则开始时反应速率__________________,反应所需的时间___________________。
⑥将c(H+)相同的三种酸均稀释10倍,pH由大到小的顺序为____________________。
某小组为测定某碳酸钠和碳酸氢钠混合物中碳酸钠的质量分数,甲、乙两组同学分别进行了下列相关实验。
方案Ⅰ.甲组同学用沉淀分析法,按如下图所示的实验流程进行实验:[已知Ba(HCO3)2可溶于水]
(1)实验时,过滤操作中,除了玻璃棒、漏斗外,还要用到的玻璃仪器为。
(2)洗涤沉淀B的操作是。
(3)若实验中测得样品质量为m g,沉淀质量为n g,则碳酸钠的质量分数为____________。
方案Ⅱ.乙组同学的主要实验流程图如下:
按如下左图所示装置进行实验:

(4)该实验中装置B盛放的物质是_____________________,分液漏斗中(填“能”或“不能”)用盐酸代替稀硫酸进行实验。
(5)在C中装碱石灰来吸收净化后的气体。
①样品中碳酸钠的质量分数越大,则实验中干燥管C在充分吸收气体前后的质量差____________________。(填“越大”、“越小”或“不变化”)
②D装置的作用是_________________________。
(6)有同学认为为了减少实验误差,在反应前后都要通入N2(如上右图),反应后通入N2的目的是______________________________。
(8分)用98%的浓硫酸(其密度为1.84g/cm3)配制100mL 1.0mol·L-1稀硫酸,若实验仪器有: A 100mL量筒 B托盘天平 C玻璃棒 D.50mL容量瓶 E.10mL量筒
F.胶头滴管 G.50mL烧杯 H.100mL容量瓶
(1)需量取浓硫酸的体积为mL
(2)实验时选用的仪器有(填序号)
(3)配制过程中,下列情况会使配制结果偏高的是(填序号)
①定容时俯视刻度线观察液面
②容量瓶使用时未干燥
③定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线
(4)在容量瓶使用方法中,下列操作不正确的是(填序号)
A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配液润洗
C.将氢氧化钠固体放在天平托盘的滤纸上,准确称量并放入烧杯中溶解后,即注入容量瓶中
D.将准确量取的18.4mol·L-1的硫酸,注入已盛有30mL水的100mL的容量瓶中,加水至刻度线
E.定容后塞好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转摇匀
现有NaCl、Na2SO4和NaNO3的混合溶液,选择适当的试剂将其转化为相应的沉淀或固体,从而实现Cl-、SO 和NO
和NO 的相互分离,实验过程如下:
的相互分离,实验过程如下:
请回答下列问题:
(1)写出上述实验过程中所用试剂的名称:试剂1为_________,试剂2为__________________,试剂4为____________________。
(2)加入过量试剂3的目的是__________________________________。
(3)在加入试剂4后,获得晶体D的实验操作④的名称_____________________