苹果酸是一种常见的有机酸,其结构简式为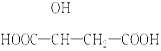 :
:
(1)苹果酸分子所含官能团的名称是 、 。
(2)写出苹果酸与足量的钠反应的化学方程式: 。
(3)写出苹果酸在浓硫酸加热下与乙酸反应的化学方程式 _____________________ 、
反应类型为 。
(4) 1mol苹果酸与足量碳酸钠充分反应生成的气体在标准状况下体积最多为 。
(一)氧化还原反应中实际上包含氧化和还原两个过程。下面是一个发生还原过程的反应式:
NO3ˉ+4H++3e-→ NO+2H2O
在下列四种物质KMnO4、Na2CO3、KI、Fe2(SO4)3中的一种物质(甲)中滴加少量稀硝酸能使上述还原过程发生。
(1)写出并配平该氧化还原反应的化学方程式:
(2)上述反应中 被还原,还原剂是 。
(3)反应生成0.3mol H2O,则转移电子的数目为 个。
(二)请配平下面方程式
CH3CH2OH+ KMnO4→ CH3CHO+ MnO2+ KOH+ H2O
取 A、B 两份物质的量浓度相等的 NaOH 溶液,体积均为 50mL,分别向其中通入一定量的 CO2后,再分别稀释为 100mL。
(1)在 NaOH 溶液中通入一定量的 CO2后,溶液中溶质的组成可能是:(填化学式)①__________②___________③____________④______________。
(2)在稀释后的溶液中分别逐滴加 0.1mol/L 的盐酸,产生的 CO2 的体积(标准状况)与所加盐酸的体积关系如图所示: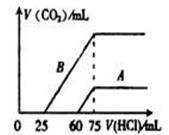
①分别加入足量的盐酸后,溶液中的溶质是_____________,原 NaOH 溶液的物质的量浓度为_________。
②A 曲线表明,原溶液通入CO2后,所得溶质的化学式为_________,与盐酸反应 产生 CO2的最大体积是_________mL(标准状况)。
③B 曲线表明,原溶液通入 CO2后,所得溶质的化学式为_________,其物质的量 之比为_________。
现有①H2SO4 ②酒精 ③液氨 ④纯碱固体 ⑤熔融的氢氧化钠 ⑥水银 ⑦三氧化硫 ⑧澄清石灰水 ⑨氯化钠溶液 ⑩CaCO3固体,其中属于盐的是(填序号,下同)_________, 属于酸性氧化物的是_________,能导电的是_____________,属于电解质的是________。
已知在25℃时,醋酸、碳酸和亚硫酸的电离平衡常数如下表:
| 醋酸 |
碳酸 |
亚硫酸 |
| Ka= 1.75×10-5 |
Ka1= 4.30×10-7Ka2 = 5.61×10-11 |
Ka1= 1.54×10-2 Ka2 = 1.02×10-7 |
(1)写出碳酸的第一步电离平衡常数表达式:Ka1 = 。
(2)在相同条件下,试比较H2CO3、HCO3-和HSO3-的酸性强弱: > > 。
(3)下图表示常温时稀释醋酸、碳酸两种酸的稀溶液时,溶液PH随水量的变化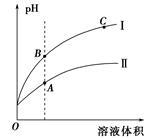
①图像中,曲线I表示的酸是 (填化学式)。
②A、B、C三点中,水的电离程度最大的是 (填字母)。
某研究性学习小组为了探究醋酸的电离情况,进行了如下实验。用pH计测定25 ℃时不同浓度的醋酸的pH,其结果如下:
| 醋酸浓度/mol·L-1 |
0.001 0 |
0.010 0 |
0.020 0 |
0.100 0 |
0.200 0 |
| pH |
3.88 |
3.38 |
3.23 |
2.88 |
2.73 |
回答下列问题:
(1)写出醋酸的电离方程式:__________________________。
(2)醋酸溶液中存在的微粒有__________________________。
(3)根据表中数据,可以得出醋酸是弱电解质的结论,你认为得出此结论的依据是__________________。
(4)从表中的数据,还可以得出另一结论:随着醋酸浓度的减小,醋酸的电离程度(选填“增大”“减小”或“不变”)__________。
(5)常温常压下,在 pH =5的稀醋酸溶液中,c(CH3COO-)= (精确值,用表达式表示)。
(6)下列方法中,可以使0.10 mol·L-1 CH3COOH溶液中CH3COOH电离程度增大的是 。
a.加入少量0.10 mol·L-1的稀盐酸
b.加入少量冰醋酸
c.加入少量氯化钠固体
d.加热CH3COOH溶液
e.加入Zn粒
f.加入少量0.10 mol·L-1的CH3COONa溶液