实验室用稀硝酸与铜反应来制备NO气体,如果采用(Ⅰ)装置(烧瓶内加入稀硝酸和铜片,必要时可加热),实验效果不十分理想,因为从观察到的现象不能有力证明反应产物是NO;有人设计了(Ⅱ)装置(橡皮塞下端连有铜丝圈),用来做该实验可以达到满意的效果。根据要求回答下列问题: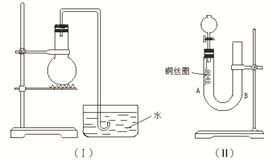
(1)用Ⅰ装置做实验时,实验过程中由于观察到烧瓶内有 现象,而不能有力证明反应产物是NO;收集NO能否用瓶口向上排空气法?答: (填“能”“否”)。
(2)用Ⅱ装置做实验时,将有关操作补充完全:
①将分液漏斗的活塞打开,从U形管的B侧管口注入稀硝酸,一直注到 为止。
a.刚好浸没铜丝下端 b.刚好浸没铜丝中部 c. 单孔塞下沿与液面间不留有空隙
②关闭活塞,用酒精灯对U形管的A侧加热,当 时,撤去酒精灯。
(3)在(2)的实验中:
①什么情况下反应自动停止? 。
何处观察到无色的NO气体? 。
②如果再将分液漏斗的活塞慢慢打开,可在分液漏斗中观察到哪些明显现象?
答: 。
为探索工业废料的再利用,某化学兴趣小组设计了如下实验流程,用含有铝、铁和铜的合金废料制取氯化铝、绿矾晶体(FeSO4·7H2O)和胆矾晶体。
请回答:
(1)写出步骤Ⅰ反应的离子方程式: 。
(2)试剂X是 。步骤Ⅰ、Ⅱ、Ⅲ中均需进行的实验操作是 。
(3)进行步骤Ⅱ时,该小组用如图所示装置及试剂制取CO2并将制得的气体通入溶液A中。一段时间后,观察到烧杯中产生的白色沉淀会逐渐减少。为了避免固体C减少,可采取的改进措施是 。
(4)用固体F制备CuSO4溶液,可设计以下三种途径:

写出途径①中反应的离子方程式 ,请选出你认为的最佳途径 说明选择的理由 。
目前,回收溴单质的方法主要有水蒸气蒸馏法和萃取法等。某兴趣小组通过查阅相关资料拟采用如下方案从富马酸废液(含溴0.27%)中回收易挥发的Br2:
(1)操作X所需要的主要玻璃仪器为 ;反萃取时加入20%的NaOH溶液,其离子方程式为 。
(2)反萃取所得水相酸化时,需缓慢加入浓硫酸,并采用冰水浴冷却的原因是: 。
(3)溴的传统生产流程为先采用氯气氧化,再用空气水蒸气将Br2吹出。与传统工艺相比,萃取法的优点是 。
(4)我国废水三级排放标准规定:废水中苯酚的含量不得超过1.00mg/L。实验室可用一定浓度的溴水测定某废水中苯酚的含量,其原理如下:
①请完成相应的实验步骤:
步骤1:准确量取25.00mL待测废水于250mL锥形瓶中。
步骤2:将4.5 mL 0.02mol/L溴水迅速加入到锥形瓶中,塞紧瓶塞,振荡。
步骤3:打开瓶塞,向锥形瓶中加入过量的0.1mol/L KI溶液,振荡。
步骤4: ,再用0.01 mol/L Na2S2O3标准溶液滴定至终点,消耗 Na2S2O3溶液15 mL。(反应原理:I2 + 2Na2S2O3 =" 2NaI" + Na2S4O6)
步骤5:将实验步骤1~4重复2次。
②该废水中苯酚的含量为 mg/L。
③步骤3若持续时间较长,则测得的废水中苯酚的含量 。(填“偏高”、“偏低”或“无影响”)。
苄叉二氯 沸点206℃)是合成苯甲醛的中间体,实验室合成苄叉二氯的装置如图所示。
沸点206℃)是合成苯甲醛的中间体,实验室合成苄叉二氯的装置如图所示。

回答下列问题:
(1)实验室常用高锰酸钾与浓盐酸制取氯气,反应的离子方程式为________;
(2)图中装置A的作用是 ;装置B的作用是____;装置D的作用是 ;
(3)仪器X的名称为 ,冷凝水从 (填“a”或“b”)口进入;装置C中甲苯与C12反应生成苄叉二氯的化学方程式为
(4)最后蒸馏收集204~208℃的馏分,蒸馏时用的冷凝管可选用右图中的 (填字母)。
(5)若实验前甲苯的质量为46 g,最后苄叉二氯的质量也是46 g,则该实验的产率为
(6)设计实验证明溶液m中含有ClO-:
工业生产的纯碱中常含有少量的NaCl杂质。某校研究性学习活动小组为了测定混合物中纯碱的质量分数,拟使用如图实验装置,先测定一定量的样品和酸反应放出二氧化碳的质量,再计算混合物中纯碱的质量分数.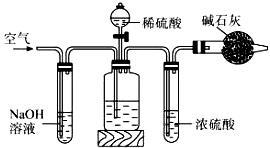
甲乙丙丁
(1)甲装置反应的离子方程式是 。
(2)乙装置反应完成后,再通数分钟空气的作用是 。
(3)若取n g样品装入广口瓶,且反应前填满碱石灰的干燥管丁总质量为m g,实验结束后称得干燥管丁的总质量为w g,则Na2CO3质量分数的计算式为 。
(4)若去掉丙装置,测得的CO2质量会 (填“偏大” “偏小”或“无影响”)。
(5)有同学认为在丁后面还要再连一个跟丁一样的装置,目的是 。
实验室配制250mL0.1mol/L的盐酸溶液,填空并请回答下列问题:
(1)配制250mL0.1mol/L的盐酸溶液需要________ml容量瓶。还需要烧杯、玻璃棒、量筒______仪器.
(2)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次) ________。
A 洗涤 B 量取 C 冷却 转移 D 摇匀 E 定容 F 计算
(3)若出现如下情况,对所配溶液浓度将有何影响?
加蒸馏水时不慎超过了刻度 ;定容时俯视____________未冷却______________.