化工中把电解饱和食盐水的工业生产叫氯碱工业,其生产流程如下:
除去食盐水中的Ca2+、Mg2+、SO42—,应分别加入下列沉淀剂:①NaOH(aq)、
②Na2CO3(aq)、③BaCl2(aq),加入沉淀剂的顺序为 (填序号);加入盐酸的作用为 。
(2)下图为实验室电解饱和食盐水的实验装置。X、Y均为石墨电极,两极周围溶液均滴有几滴酚酞试液。
①电解一段时间后,X电极及附近溶液能观察到的现象是 ;
Y电极上的电极反应式为 ,检验该极产生的气体的方法是 。
②电解饱和食盐水的离子方程式为 ;若饱和食盐水体积为200mL,且忽略电解过程中的体积变化及气体溶解,当两极共收集到气体(共两种)44.8mL(标准状况)时,溶液的pH= 。
(9分)(1)按下图装置进行实验,可观察到的现象有:。其中Zn极发生反应(填“氧化”或“还原”),写出电极反应式。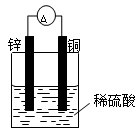
(2)有同学把Zn粒放入盛有稀盐酸的试管中,加入几滴CuCl2溶液,气泡放出的速率加快。其原因是。
(3)美国阿波罗宇宙飞船上使用了一种新型装置,其构造如图所示:a、b两个电极均由多孔的碳块组成。它的负极反应物为________,当正极消耗5.6 L(标准状况)气体时,外电路转移的电子数为________。
氢能源是21世纪极具开发前景的新能源之一,它既是绿色能源,又可循环使用。下图是氢能源循环体系图。回答下列问题:
(1)图中两个框中的X、Y为循环过程中反应物和生成物的分子式。则X是;Y是、(填分子式)。
(2)从能量转换的角度看,过程II主要是_______能转化为________能。
(3)由氢气和氧气反应生成1mol水蒸气放热241.8KJ,写出该反应的热化学方程式
(本小题满分8分)某学生为了探究锌与盐酸反应过程中的速率变化,他在100mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值,体积已换算成标准状态):
| 时间(min) |
0 |
1 |
2 |
3 |
4 |
5 |
| 氢气体积(mL) |
0 |
50 |
120 |
232 |
290 |
310 |
(1)哪一段时段的反应速率最快,原因是。
(2)求2~3分钟时间段以盐酸的浓度变化来表示的该反应速率(设溶液体积不变)。
(3)如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,可以在盐酸中分别加入等体积的下列溶液:
A.蒸馏水 B.NaCl溶液 C.Na2CO3溶液 D.CuSO4溶液
你认为可行的是(填编号)。
(本小题满分8分)乙烯来自石油的重要化工原料,其产量是一个国家石油化工水平的标志。请回答:
(1) (3分)乙烯通入溴的四氯化碳溶液中,观察到的现象是 ;其反应方程式为 ;乙烯在一定条件下发生加聚反应的化学方程式为 。
(2) (3分)此外,乙烯大量用来生产环氧乙烷,生产工艺主要有两种:
工艺一: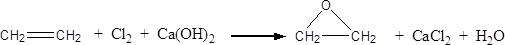
工艺二:
根据绿色化学的原则,理想的生产工艺是原子经济性好的反应,因此,在实际生产中,应采用工艺更环保、更经济。
(本小题满分14分)a、b、c、d、e四种短周期元素的原子序数逐渐增大。a为非金属元素,且a、e同主族,c、d为同周期的相邻元素。e原子的质子数等于c、d原子最外层电子数之和。b原子最外层电子数是内层电子数的2倍。c的氢化物分子中有3个共价键。试推断:
(1)写出b元素在周期表中的位置;
(2)有a、c、d所形成的离子化合物是它与e的最高价氧化物对应水化物的溶液加热时反应的离子方程式是;
(3)c的单质的电子式为。
(4)b和d相比,非金属性较强的是(用元素符号表示),下列事实能证明这一结论的是(选填字母序号)。
| A.常温下,b的单质呈固态,d的单质呈气态 |
| B.d的氢化物的稳定性强于b的氢化物 |
| C.b与d形成的化合物中,b呈正价 |
| D.d的氢化物的沸点高于b的氢化物 |
(5)元素b形成的一种单质具有硬度大、熔点高的物理性质,据此判断该单质的晶体类型为。